题目内容
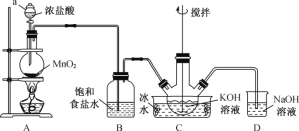
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:
回答下列问题:
(1)制备KClO。
①装置B的作用______________________。
②装置C中三颈烧瓶置于冰水浴中的目的是________________。
(2)制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为___________。
②向装置C中加入饱和KOH溶液,析出紫黑色晶体,过滤。
(3)测定K2FeO4纯度。
测定制备的K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:
a.Fe![]() +Cr
+Cr![]() +2H2O
+2H2O![]() Cr
Cr![]() +Fe(OH)3↓+OH-
+Fe(OH)3↓+OH-
b.2Cr![]() +2H+
+2H+![]() Cr2
Cr2![]() +H2O
+H2O
c.Cr2![]() +6Fe2++14H+
+6Fe2++14H+![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
称取2.0g 制备的K2FeO4样品溶于适量KOH 溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。取25.00 mL 加入稀硫酸酸化,用0.10 mol·L-1的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,计算该K2FeO4 样品的纯度,写出计算过程。(保留小数点后一位)________
【答案】饱和食盐水吸收挥发的HCl 防止Cl2与KOH反应生成KClO3 3ClO-+2Fe3++10OH-=2Fe42-+3Cl-+5H2O 79.2%
【解析】
(1)氯气在饱和食盐水中的溶解度很小,用饱和食盐水吸收挥发的HCl;
(2)Cl2与KOH溶液在较高温度下反应生成KClO3,为保证反应生成KClO,需要冰水浴将反应温度控制在0~5℃下进行;
(3)将硝酸铁溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,根据电子得失守恒和原子守恒可得反应的方程式;
(4)根据反应a、b、c,可得关系式2FeO42-~2CrO42-~Cr2O72-~6Fe2+,通过关系式可以求得。
(1)装置B中放的是饱和食盐水,新生成的氯气中混有HCl气体,氯气在饱和食盐水中的溶解度很小,用饱和食盐水吸收挥发的HCl;
(2)Cl2与KOH溶液在较高温度下反应生成KClO3,为保证反应生成KClO,需要冰水浴将反应温度控制在0~5℃下进行,故答案为:防止Cl2与KOH反应生成KClO3;
(3)将硝酸铁溶液缓慢滴加到KClO饱和溶液中即可制取K2FeO4,根据电子得失守恒和原子守恒可知反应的方程式为:2Fe(NO3)3+3KClO+10KOH=2K2FeO4+3KCl+6KNO3+5H2O,离子方程式为:3ClO-+2Fe3++10OH-=2Fe42-+3Cl-+5H2O;
(4)根据反应a、b、c,可得关系式2FeO42-~2CrO42-~Cr2O72-~6Fe2+,25mLK2FeO4溶液中K2FeO4的物质的量n(K2FeO4)= ![]() n(Fe2+)=0.10 mol·L-1×0.024L×
n(Fe2+)=0.10 mol·L-1×0.024L×![]() =0.0008mol,250mL样品溶液中m(K2FeO4)=0.0008mol×198g/mol×10=1.584g,该K2FeO4 样品的纯度为
=0.0008mol,250mL样品溶液中m(K2FeO4)=0.0008mol×198g/mol×10=1.584g,该K2FeO4 样品的纯度为![]() ×100%=79.2%。
×100%=79.2%。