题目内容
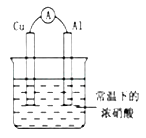
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4时刻测得各物质的浓度如下表。据此判断下列结论正确的是

A.在t3时刻反应已经停止
B.A的转化率比B的转化率低
C.在容器中发生的反应为: 2A+B![]() 2C
2C
D.在t2~t3内A的平均反应速率为:[1/(t3-t2)]mol·L-1·s-1[
【答案】D
【解析】
A、可逆反应达到了平衡状态,但是反应仍然进行,故A错误;
B、根据表中的数据,t1→t2,消耗了A3mol/L、B1.5mol/L,生成了1.5mol/LC,故反应方程式为:2A+BC,反应前A、B的浓度之比小于2:1,反应过程中消耗的A、B的浓度之比等于2:1,则转化率A的大于B,故B错误;
C、由于ABC的反应方程式为:2A+BC,故C错误;
D、反应速率等于浓度变化比时间,t2到t3,A的浓度变化为1mol/L,时间为(t3-t2),故A的平均反应速率为:![]() mol/(Ls),故D正确;
mol/(Ls),故D正确;
故选:D。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
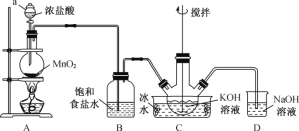
一线名师口算应用题天天练一本全系列答案【题目】工、农业废水以及生活污水中浓度较高的![]() 会造成氮污染。工业上处理水体中
会造成氮污染。工业上处理水体中![]() 的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
的一种方法是零价铁化学还原法。某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下。
(1)先用稀硫酸洗去废铁屑表面的铁锈,然后用蒸馏水将铁屑洗净。
①除锈反应的离子反程式是__________。
②判断铁屑洗净的方法是__________。
(2)将KNO3溶液的pH调至2.5。从氧化还原的角度分析调低溶液pH的原因是__________。
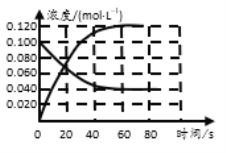
(3)将上述处理过的足量铁屑投入(2)的溶液中。如图表示该反应过程中,体系内相关离子浓度、pH随时间变化的关系。请根据图中信息回答:

①t1时刻前该反应的离子方程式是__________。
②t2时刻后,该反应仍在进行,溶液中![]() 的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
的浓度在增大,Fe2+的浓度却没有增大,可能的原因是__________。
(4)铁屑与KNO3溶液反应过程中向溶液中加入炭粉,可以增大该反应的速率,提高![]() 的去除效果,其原因是__________。
的去除效果,其原因是__________。
【答案】 Fe2O3+6H+=2Fe3++3H2O 测最后一次洗涤液的pH,若为7,则说明铁屑已洗净(或取少量最后一次洗涤液加入BaCl2溶液,若无明显现象,则说明铁屑已洗净) ![]() 在酸性条件下的氧化性强,易被铁屑还原 4Fe+
在酸性条件下的氧化性强,易被铁屑还原 4Fe+![]() +10H+=4Fe2++
+10H+=4Fe2++![]() +3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
+3H2O 生成的Fe2+水解 炭粉和铁构成了无数微小的原电池加快反应速率
【解析】(1). ①. 铁锈的主要成分是Fe2O3,与稀硫酸反应生成硫酸铁和水,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
②. 判断铁屑是否洗净的方法是测最后一次洗涤液的pH,若为7,则说明铁屑已洗净,故答案为:测最后一次洗涤液的pH,若为7,则说明铁屑已洗净;
(2). pH调至2.5,是因为NO3-在酸性条件下的氧化性强,易被铁屑还原,故答案为:NO3-在酸性条件下的氧化性强,易被铁屑还原;
(3). ①. 根据图示可知,在t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则在t1时刻前是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O,故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
②. 根据反应4Fe+NO3-+10H+=4Fe2++NH4++3H2O可知,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,所以原因是生成的Fe2+水解所致,故答案为:生成的Fe2+水解;
(4). 构成原电池可以加快化学反应速率,炭粉和铁屑构成了无数微小的原电池加快反应速率,故答案为:炭粉和铁构成了无数微小的原电池加快反应速率。
点睛:本题主要考查硝酸、铁及其化合物的化学性质,试题难度中等。熟练掌握硝酸的化学性质和铁及其化合物的性质是解答本题的关键,本题的难点是第(3)问,解答本问时,需先仔细审图,根据图示得出t1时刻前,硝酸根离子、氢离子浓度是逐渐减小的,亚铁离子浓度是逐渐增大的,所以t1时刻前是金属铁和硝酸之间的反应,随着反应的进行,溶液中铵根离子浓度在增大,亚铁离子的浓度却没有增大,说明是生成的亚铁离子发生了水解反应,据此解答本题即可。
【题型】综合题
【结束】
18
【题目】含有K2Cr2O7的废水具有较强的毒性,工业上常用钡盐沉淀法处理含有K2Cr2O7的废水并回收重铬酸,具体的流程如下:

已知:CaCr2O7、BaCr2O7易溶于水,其它几种盐在常温下的溶度积常数如下表所示。
物质 | CaSO4 | CaCrO4 | BaCrO4 | BaSO4 |
溶度积 | 9.1×10-6 | 2.30×10-2 | 1.17×10-10 | 1.08×10-10 |
(1)用离子方程式表示K2Cr2O7溶液中同时存在K2CrO4的原因(将离子方程式补充完整):
![]() +__________=
+__________=![]() +__________。____________
+__________。____________
(2)向滤液1中加入BaCl2·2H2O的目的,是使![]() 从溶液中沉淀出来。
从溶液中沉淀出来。
①结合上述流程说明熟石灰的作用:__________。
②结合表中数据,说明选用Ba2+而不选用Ca2+处理废水的理由:__________。
③研究温度对![]() 沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下
沉淀效率的影响。实验结果如下:在相同的时间间隔内,不同温度下![]() 的沉淀率
的沉淀率 ,如下图所示。
,如下图所示。

已知:BaCrO4(s) ![]() Ba2+(aq)+
Ba2+(aq)+ ![]() ΔH>0
ΔH>0
![]() 的沉淀效率随温度变化的原因是__________。
的沉淀效率随温度变化的原因是__________。
(3)向固体2中加入硫酸,回收重铬酸。
①硫酸浓度对重铬酸的回收率如下图所示。结合化学平衡移动原理,解释使用0.450mol/L的硫酸时,重铬酸的回收率明显高于使用0.225mol/L的硫酸的原因:__________。

②回收重铬酸的原理如图所示。当硫酸浓度高于0.450mol/L时,重铬酸的回收率没有明显变化,其原因是__________。

(4)综上所述,沉淀BaCrO4并进一步回收重铬酸的效果与__________有关。