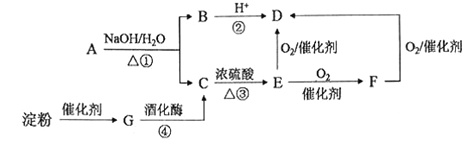
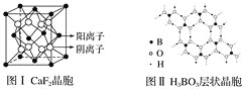
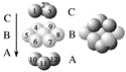
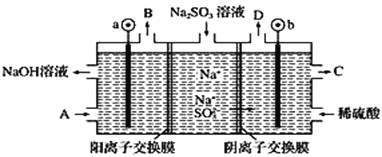
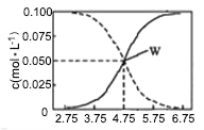
题目内容
【题目】已知:C(s) + H2O(g) =CO(g) + H2(g) ΔH=a kJ·mol-1
2C(s) +O2(g) =2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+332B.+118C.+350D.+130
【答案】D
【解析】
C(s) + H2O(g) =CO(g) + H2(g) ΔH=a kJ·mol-1 ①
2C(s) +O2(g) =2CO(g) ΔH=-220 kJ·mol-1 ②
将①-②×![]() 得:H2O(g) = H2(g)+
得:H2O(g) = H2(g)+![]() O2(g) ΔH=(a+110) kJ·mol-1
O2(g) ΔH=(a+110) kJ·mol-1
2×462-(436+![]() ×496)=a+110,a=+130。
×496)=a+110,a=+130。
故选D。

【题目】碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
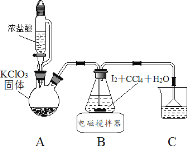
HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4 -+ Cl- |
回答下列问题:
步骤Ⅰ用 Cl2 氧化 I2 制取 HIO3
(1)装置 A 中发生反应的化学方程式_______。
(2)装置 B 中的 CCl4 可以加快反应速率,原因_______。
(3)反应结束后,获取 HIO3 溶液的操作中,所需玻璃仪器有烧杯、________和_______。
步骤Ⅱ用 KOH 中和 HIO3 制取 KIO3
(4)该中和反应的离子方程式为_______。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______(填化学式)而降低 KIO3 的产量。
(5)往中和后的溶液中加入适量_______,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2 饱和溶液过量,则无蓝色出现,原因是_______。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3 溶液的体积为 24.00 mL。则产品中 KIO3 的质量分数为_______。[M(KIO3)=214.0 g·mol-1]