题目内容
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是( )
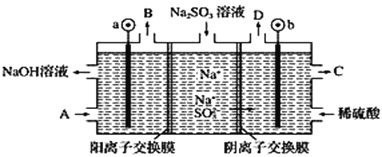
A.a电极发生还原反应,当有1 mol Na+通过阳离子交换膜时,a极生成11.2 L气体
B.若D是混合气体,则可能含有SO2、O2等成分
C.b电极上的主反应是![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C溶液是较浓的硫酸溶液
【答案】A
【解析】
依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极,a为阴极,b为阳极,SO32-在阳极失去电子变成SO42-,可能伴有氢氧根离子放电生成氧气,所以C口流出的物质是H2SO4,阴极区放电离子为氢离子生成氢气,据此解答。
A. 未指明气体状况,不能确定生成氢气的体积,故A错误;
B. 亚硫酸根离子与稀硫酸反应生成二氧化硫,b极伴随副反应氢氧根离子失去电子生成氧气,所以若D是混合气体,则可能含有SO2、O2等成分,故B正确;
C. b极为阳极,亚硫酸根离子在阳极上失去电离生成硫酸根离子,电极反应式为:![]() -2e-+H2O=
-2e-+H2O=![]() +2H+,故C正确;
+2H+,故C正确;
D. 水为弱电解质,导电能力弱,随着反应不断进行,a极溶液中氢氧根离子不断减少,应及时补充稀氢氧化钠,增强溶液导电性,b为阳极,![]() 在阳极失去电子变成
在阳极失去电子变成![]() 所以C口流出的物质是浓硫酸,故D正确;
所以C口流出的物质是浓硫酸,故D正确;
故选:C。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验 | 实验III | 实验IV | |
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:
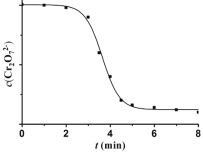
臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。