题目内容
【题目】25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
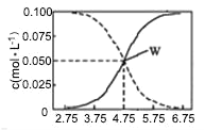
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
【答案】A
【解析】
A. 由电荷守恒及c(CH3COOH)+c(CH3COO-)=0.1molL-1可知,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=c(CH3COO-)+c(CH3COOH)=0.1mol/L,故A正确;
B.W点由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),而 c(CH3COO-)=c(CH3COOH),故有c(Na+)+c(H+)═c(CH3COOH)+c(OH-),故B错误;
C. 由图可知,pH=4.75时,c(CH3COO-)=c(CH3COOH),故当pH=5.5 时,有c(CH3COO-)>c(CH3COOH),且溶液显酸性,则c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-),故C错误;
D. 向W点所表示溶液中通入0.05molHCl气体,与溶液中醋酸根恰好反应,反应后溶液近似为CH3COOH、NaCl混合溶液,溶液中氢离子源于CH3COOH、水的电离,根据质子守恒得:c(H+)═c(CH3COO)+c(OH),而此时c(CH3COO)≠c(CH3COOH),故D错误;
故选A。

【题目】在不同温度下,向V L密闭容器中加入0.5mol NO和0.5mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
N2(g)+CO2(g) ΔH=-Q kJ·mol-1(Q>0),达到平衡时的数据如下表:
温度/℃ | n(C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是( )
A.由上述信息可推知:T1>T2
B.T2℃条件下,若反应达到平衡后再缩小容器的体积,c(N2):c(NO)增大
C.T1℃条件下,若开始时反应物的用量均减小一半, 平衡后NO的转化率增大
D.![]() ℃条件下,该反应的平衡常数
℃条件下,该反应的平衡常数![]()