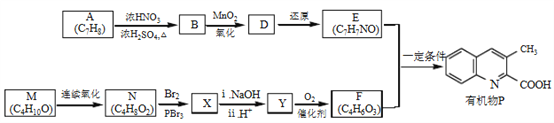
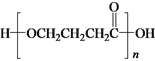题目内容
【题目】下列叙述中不正确的是( )
A.在熔融状态下和溶解于水时均不导电的化合物,叫做非电解质
B.电解质、非电解质都对化合物而言,单质不在此范畴
C.在水中的电解质一定都导电性很强
D.水是极弱的电解质
【答案】C
【解析】在水中的电解质也有强弱之分,部分难溶于水的强电解质也不导电。
所以答案是:C
【考点精析】本题主要考查了强电解质和弱电解质的概念和判断的相关知识点,需要掌握强电解质:离子键、强极性键、完全电离;弱电解质:极性键、部分电离才能正确解答此题.

练习册系列答案
相关题目
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如下图(忽略溶液体积的变化、H2S的挥发)。

①pH=11时,溶液中的c(H2S)+c(HS-)=________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=________时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(2)25 ℃,两种酸的电离常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HCO![]() 的电离常数表达式K=________。
的电离常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为___________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________________。