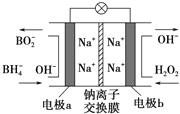
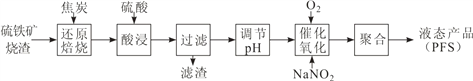
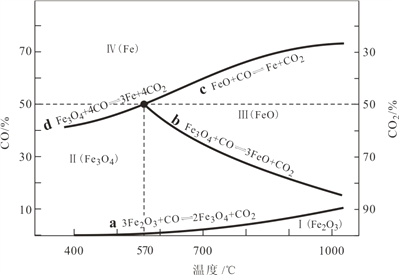
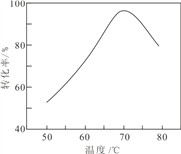
题目内容
【题目】材料是人类赖以生存和发展的重要物质基础。请回答下列问题:
(1)有机合成材料的出现是材料发展史上的一次重大突破。人们常说的三大合成材料是指__________________、__________________、__________________。
(2)聚氯乙烯的商品名为PVC,其结构简式为____________________,PVC管材中还需要加入具有特殊用途的添加剂,如_______________、________________等,因为PVC具有_____________性,所以由它制得的材料可反复加工、多次使用。
(3)合金是生活中常见的材料,某合金具有密度小、强度高的优良性能,常用于制造门窗框架,该合金中含量最高的金属为_______(填元素符号),该元素在周期表中的位置为______________________________。
(4)玻璃是一种常见的硅酸盐材料,制备普通玻璃的原料有CaCO3、_______和_______。
【答案】 塑料 合成纤维 合成橡胶 ![]() 增塑剂 防老化剂 热塑 Al 第三周期第ⅢA族 Na2CO3 SiO2
增塑剂 防老化剂 热塑 Al 第三周期第ⅢA族 Na2CO3 SiO2
【解析】(1)三大合成材料是指:塑料、合成纤维和合成橡胶。
(2)聚氯乙烯是氯乙烯加聚的产物,其结构简式为![]() 。由聚氯乙烯制备PVC管材的过程中,一般需要添加增塑剂和防老化剂(或者说抗老化剂)以改善其性能。因为聚氯乙烯是热塑型的塑料,所以由它制得的材料可反复加工、多次使用。
。由聚氯乙烯制备PVC管材的过程中,一般需要添加增塑剂和防老化剂(或者说抗老化剂)以改善其性能。因为聚氯乙烯是热塑型的塑料,所以由它制得的材料可反复加工、多次使用。
(3)某合金具有密度小、强度高的优良性能,常用于制造门窗框架,所以该合金是铝合金。由此得到该合金中含量最高的金属为Al。Al在周期表中的位置为第三周期ⅢA族。
(4)普通玻璃是由碳酸钙、二氧化硅和碳酸钠加强热制取的,

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
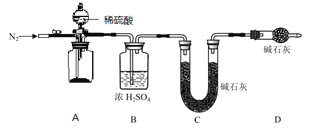
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________