题目内容
5.外围电子构型为3d104s1的元素R( )| A. | 位于第四周期第IA族 | |
| B. | 能形成稳定的R2+离子 | |
| C. | 在化学反应中,首先失去3d上的电子 | |
| D. | 原子序数为28 |
分析 外围电子排布为3d104s1的元素,根据4s可以判断该元素位于第4周期,再根据外围电子总数为11可知该元素位于周期表从左向右第11列,据此判断该元素为铜,据此分析.
解答 解:根据外围电子排布3d104s1可知,该元素最外层为4s,则位于周期表中第4周期,该元素外围电子总数为11,则该元素位于周期表从左向右第11列,其中ⅤⅢ为8、9、10纵行,则该元素位于周期表ⅠB族,该元素为铜,原子序数为29,能形成稳定的R2+离子,化学反应中,首先失去4s上的电子,所以ACD错误,B正确;
故选B.
点评 本题考查了原子核外电子排布及元素周期表结构,题目难度不大,熟练掌握元素周期表结构为解答关键,注意明确原子核外电子排布式的书写方法,试题侧重基础知识的考查,培养了学生灵活应用所学知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.常温下0.1mol/LNH3•H2O的pH=a,下列能使溶液pH=a-1的措施是( )
| A. | 加水,使溶液体积变为原来的10倍 | B. | 升高温度(不考虑NH3的挥发) | ||
| C. | 加入适量的NH4Cl固体 | D. | 加入等体积0.2mol/L的氢氧化钠 |
16.下列说法中正确的是( )
| A. | 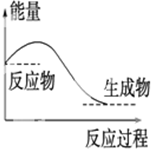 对于如图所示的过程,是放出能量的过程 | |
| B. | 由“C(石墨)=C(金刚石)”反应为吸热,可知,金刚石比石墨稳定 | |
| C. | 由水变成冰是放热反应 | |
| D. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
13.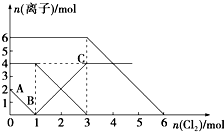 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
 已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为6 mol | |
| C. | 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
20.下列式子是表示氨水中可能存在氢键:①O-H…N ②O-H…O ③N-H…N ④N-H…O.其中正确的是( )
| A. | ①②③④ | B. | ②③④ | C. | ①③ | D. | ②④ |
10.在下列溶液中,各组离子一定能够大量共存的是( )
| A. | 能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br- | |
| B. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液:Fe2+、Mg2+、NO${\;}_{3}^{-}$、Cl- | |
| C. | 含有大量Al3+的溶液:Na+、Cl-、AlO${\;}_{2}^{-}$、OH- | |
| D. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO${\;}_{4}^{2-}$、S2-、SO${\;}_{3}^{2-}$ |
17. 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
 已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )
已知苯环上与硝基相邻的卤原子的反应活性很强,易与NaOH溶液发生水解反应.有关如图所示化合物的说法不正确的是( )| A. | 既可以催化加氢,又可以使酸性高锰酸钾溶液褪色 | |
| B. | 既可以与FeCl3溶液发生显色反应,又可以与Na2CO3溶液反应 | |
| C. | 1mol该化合物最多可以与7molNaOH反应 | |
| D. | 可以与Br2的CCl4溶液发生加成反应,但不可以在光照下与Br2发生取代反应 |
14. 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下
请回答下列问题:
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程: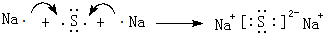 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
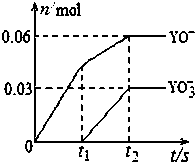
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.
 有关元素X、Y、Z、D、E的信息如下
有关元素X、Y、Z、D、E的信息如下| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,核外最外层电子数是其电子层数的2倍,其单质在X的单质中燃烧,产生的气体通入品红中,品红褪色. |
| D | 最高价氧化物对应的水化物,是强电解质,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
(1)X的一种氢化物可用于实验室制取X的单质,其反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
(2)E元素与Y元素可形成EY2和EY3两种化合物,下列说法正确的是(填序号)①④.
①保存EY2溶液时,需向溶液加入少量E单质
②通常实验室配制EY3溶液时,直接用水溶解EY3固体即可
③EY2只能通过置换反应生成,EY3只能通过化合反应生成
④铜片、碳棒和EY3溶液组成原电池,电子由铜片沿导线流向碳棒
(3)用电子式表示D2Z的形成过程:
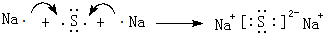 ,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-
,D2Z水溶液显碱性,用离子方程式表示其原因S2-+H2O?HS-+OH-(4)2009年3月,墨西哥、美国等多国连接暴发甲型H1N1型流感,防控专家表示,含Y消毒剂和过氧化物可防甲型H1N1流感.YO2是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KYO3在H2ZO4存在下与D2ZO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H+=2ClO2+SO42-+H2O.
(5)将一定量的Y单质通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中
有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是16.8g,该反应中转移电子的物质的量是0.21mol.