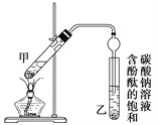
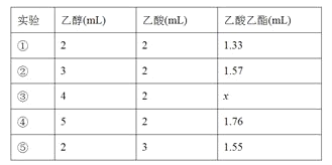
题目内容
【题目】室温下,用0.10 mol·L-1KOH溶液滴定10.00 mL 0.10 mol·L-1H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。请回答下列问题:
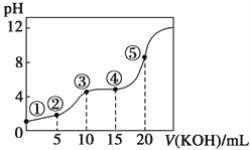
(1)点①所示溶液中,Kw=__________。
(2)点②所示溶液中的电荷守恒式为______________________________________。
(3)点③所示溶液中存在________种平衡。
(4)点④所示溶液中的物料守恒式为0.10 mol·L-1=___________________________。
(5)点⑤所示溶液中各离子浓度的大小顺序为________________________________。
(6)上述5点所示溶液中,水的电离程度最大的是_______,最小的是________(用序号回答)。
【答案】1.0×10-14 c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-) 3 c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-) c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+) ⑤ ①
【解析】
(1)根据水的离子积只受温度影响,温度不变,水的离子积不变分析;
(2)根据溶液中存在的离子写出电荷守恒式;
(3)根据点③时两溶液恰好完全反应生成了KHC2O4分析;
(4)根据点④所示的溶液的体积25mL计算出溶液中各组分的浓度;
(5)根据点⑤所示的溶液中,溶质只有K2C2O4分析各离子浓度的大小;
(6)根据H2C2O4的存在会抑制水的电离,而K2C2O4的存在会促进水的电离判断。
(1)在任何的溶液中均存在水的离子积常数,室温下水的离子积为:KW=1×10-14,故答案为:1×10-14;
(2)溶液中所有阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数,即c(H+)+c(K+)=c(HC2O4-)+c(OH-)+2c(C2O42-),故答案为:c(H+)+c(K+)=c(HC2O4-)+c(OH-)+2c(C2O42-);
(3)点③时两溶液恰好完全反应生成了KHC2O4,因此存在KHC2O4的电离平衡和水解平衡,还有水的电离平衡,总共存在3种平衡,故答案为:3;
(4)点④所示的溶液的体积25mL,根据物料守恒:c(HC2O4-)+c(H2C2O4)+c(C2O42-)=0.10mol/L×![]() =0.04mol/L;c(K+)=0.10mol/L×
=0.04mol/L;c(K+)=0.10mol/L×![]() =0.06mol/L,所以0.10molL-1=c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+),故答案为:c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+);
=0.06mol/L,所以0.10molL-1=c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+),故答案为:c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+);
(5)点⑤所示的溶液中,溶质只有K2C2O4,水解后溶液显示碱性,离子浓度大小关系为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故答案为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(6)H2C2O4的存在会抑制水的电离,而K2C2O4的存在会促进水的电离,所以水的电离程度最大的是K2C2O4浓度最大的⑤,水的电离程度最小的是H2C2O4span>的浓度增大的①,故答案为:⑤;①。