��Ŀ����
����Ŀ����֪�������ݣ�
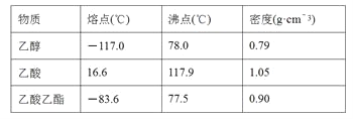
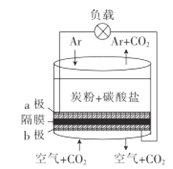
ijѧ����ʵ������ȡ������������Ҫ�������£�
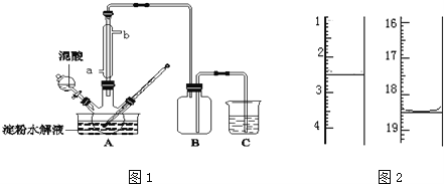
������2 mLŨ���ᡢ3 mL�Ҵ�(��18O)��2 mL����Ļ����Һ��
�ڰ�ͼ���Ӻ�װ��(װ������������)��������Һ����С����ȼ���3��5 min��
�۴��Թ����ռ���һ���������ֹͣ���ȣ������Թ��Ҳ�������Ȼ���ô��ֲ㡣
�ܷ��������������ϴ�ӡ����
(1)���Ƣ��л����Һ�ķ���Ϊ____________����Ӧ��Ũ�����������________________��д����ȡ���������Ļ�ѧ����ʽ��____________��
(2)����ʵ���б���̼������Һ��������(����ĸ)_________��
A���к�������Ҵ� B���к����Ტ�����Ҵ�
C�����������������ܽ� D�������������ɣ���������
(3)���������ҪС����ȼ��ȣ�����Ҫ������_______����������۲쵽��������_________���������Թ��е����ʷ����Եõ���������������ʹ�õ�������________������ʱ����������Ӧ������________________(�����¿ڷ��������Ͽڵ���)����
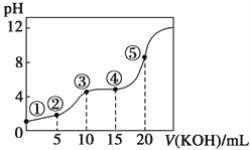
(4)��ͬѧ����ʵ�飬�ó��Ҵ�������������͵õ��������������������±���
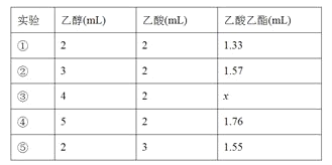
��������x�ķ�Χ��__________________��ʵ��٢ڢ�̽������_____________��
���𰸡���ŨH2SO4�����Ҵ��У��ӱ���Ȼ���������(���Ƚ��Ҵ��������Ϻ��ټ�Ũ���Ტ�ڼ�������в�����) ��������ˮ�� CH3COOH��CH3CH2![]() OH
OH![]() CH3CO18OCH2CH3��H2O BC �����Ȼᵼ�´�����ԭ����������ʧ Һ��ֲ㣬�ϲ�Ϊ��ɫ����ζҺ�壬�²�Ϊdz��ɫҺ�壬���²�Һ����ɫ��dz ��Һ©�� �Ͽڵ� 1.57��1.76 �����Ҵ�����������������IJ�����Ӱ��
CH3CO18OCH2CH3��H2O BC �����Ȼᵼ�´�����ԭ����������ʧ Һ��ֲ㣬�ϲ�Ϊ��ɫ����ζҺ�壬�²�Ϊdz��ɫҺ�壬���²�Һ����ɫ��dz ��Һ©�� �Ͽڵ� 1.57��1.76 �����Ҵ�����������������IJ�����Ӱ��
��������
(1).Ũ������ܶȴ����Ҵ������ᣬ���ʱҪ����������Ҵ��������У�������Ӧ�Ļ����������ǻ������⣬�����ɵ����к���18O��
(2)����̼������Һ�ɳ�ȥ�������������е����ᣬ�ܽ��Ҵ������������������ܽ�Ȳ�������Һ��ֲ㡣
(3)���ᡢ�Ҵ��ӷ��������������ܶȱ�ˮС����״Һ�壬������ˮ������ζ���÷�Һ�����뻥�����ܵ�Һ�壻
(4)�����Ҵ�������ƽ�������ƶ����ڢ�������������1mL �Ҵ������
(1)���ʱŨ�����൱�ڱ�ϡ�ͣ���Ӧ��ŨH2SO4�����Ҵ��У�Ȼ��������ᣬҲ���Ƚ��Ҵ��������Ϻú��ټ���Ũ�����������Ӧ��������Ϊ���淴Ӧ��ʹ��Ũ����ɼӿ�������Ӧ�����ʣ�Ũ���������ˮ�ԣ���������ƽ�����������ķ����ƶ������ᡢ�Ҵ���Ũ������������������������ˮ������������Ӧ�Ļ����������ǻ������⣬�����ɵ����к���18O����Ӧ�ķ���ʽ��CH3COOH��CH3CH2![]() OH
OH![]() CH3CO18OCH2CH3��H2O��
CH3CO18OCH2CH3��H2O��
(2) ����̼������Һ�ɳ�ȥ�������������е����ᣬ�ܽ��Ҵ������������������ܽ�Ȳ�������Һ��ֲ㣬��ѡBC��
(3)�ɱ�������֪�Ҵ��ķе�(78.0 ��)�����������ķе�(77.5 ��)�ܽӽ������ô����ȣ��������Ҵ��ᱻ��������������ԭ�ϵĴ�����ʧ�������ܶ�С��ˮ���ܶȣ����ϲ�Ϊ��״����ζ����ɫҺ�壬����һ��������������������������Na2CO3��Ӧ�����²�Һ���ɫ��dz�����ֲ��Һ����뿪����ʹ�÷�Һ©������Һʱ�ϲ�Һ��Ӧ���Ͽڵ�����
(4) �����Ҵ�������ƽ�������ƶ�����������x�ķ�Χ��1.57��1.76���ڢ�������������1mL �Ҵ������ᣬʵ��٢ڢ�̽�������Ҵ������������ĸı�������ʵ�Ӱ���������������ʵ������֪�������Ҵ�������������������������������ӡ�

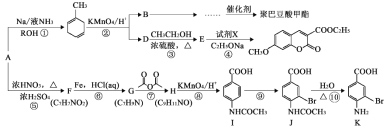
 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�����Ŀ������ѡ���е�ԭ������������Ӧ���ǣ� ��
ѡ�� | ���� | ԭ������ |
A | ��H2O2�м���MnO2���ܼ���H2O2�ķֽ����� | MnO2�����˷�Ӧ����Ļ�� |
B | ��5mL 0.005mol��L-1FeCl3��Һ�м���5mL0.010mol��L-1KSCN��Һ����Һ�ʺ�ɫ���ٵμ�1ml1 mol��L-1KCl��Һ����Һ��ɫ��dz | ����������Ũ�ȣ�ƽ�����淴Ӧ�����ƶ� |
C | ��ʢ��NO2������ܱ�������������ˮ�У�������������ɫ���� | 2NO2��g�� |
D | ���ܱ��������з�Ӧ��A+xB��g�� | ��AΪ���塢x>1 |
A.AB.BC.CD.D