题目内容
【题目】为了探究某浅黄色固体化合物X(含四种元素)的组成。某化学兴趣小组称取 3.60g 该固体化合物,用热重法对其进行分析,得到剩余固体的质量随温度变化的曲线如图所示。
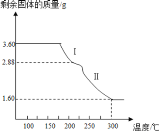
已知:① 热分解后得到的无色无味气体能完全被足量澄清石灰水吸收,并得到 4.00g白色沉淀;
② 热分解后剩余的固体呈红棕色,溶于盐酸后得到黄色溶液。请回答:
(1)X 的化学式是_____。
(2)固体X 在 300℃下反应的化学方程式是_____。
(3)将热分解后剩余的红棕色继续升温加热至一定温度,可生成1.55g黑色固体(纯净物),请设计实验方案检验黑色固体中的阳离子_____。
(4)该兴趣小组进一步查阅资料发现,在隔绝空气加热条件下,该化合物 X 还生成黑色能自燃并且具有铁磁性的粉末。则其可能发生的化学方程式是_________________________________。
【答案】FeC2O4·2H2O 4FeC2O4·2H2O+3O2=== 2Fe2O3+8CO2+8H2O 先取少量黑色固体溶解在盐酸中,分成两支试管,往其中一支里滴加少量KSCN溶液,出现血红色,说明原黑色固体中含Fe3+;往另外一支试管中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀,说明原黑固体中含Fe2+ FeC2O4·2H2O Fe+2CO2+2H2O
Fe+2CO2+2H2O
【解析】
⑴浅黄色固体化合物X,第一个阶段可能失去结晶水,得出水的物质的量,得出二氧化碳的物质的量和n(C),得出氧化铁的物质的量和n(Fe),根据质量守恒得出氧的质量和n(O),根据元素比例关系得出n(Fe): n(C): n(O): n(H2O) ,再得出X的化学式。
⑵固体X在300℃下与氧气反应生成氧化铁、二氧化碳和水。
⑶将热分解后剩余的红棕色继续升温加热至一定温度,可生成1.55g黑色固体(纯净物),质量减少,主要验证黑色固体中是否含有亚铁离子和铁离子。
⑷在隔绝空气加热条件下,该化合物 X 还生成黑色能自燃并且具有铁磁性的粉末即为铁粉,根据氧化还原反应原理分析化合价升降,得到产物为二氧化碳、铁粉和水。
⑴浅黄色固体化合物X,第一个阶段可能失去结晶水,质量为0.72g,物质的量为0.04mol,则固体2.88g热分解后得到的无色无味气体能完全被足量澄清石灰水吸收,并得到 4.00g白色沉淀;说明热分解生成了CO2,物质的量为0.04mol,则n(C)=0.04mol,碳的质量为0.04mol×12gmol1= 0.48g,热分解后剩余的固体呈红棕色,溶于盐酸后得到黄色溶液,说明生成了氧化铁,物质的量为0.01mol,n(Fe) = 0.02mol,铁的质量为0.02mol×56gmol1= 1.12g,则还有氧的质量为2.88g 0.48g 1.12g = 1.28g,则n(O)=0.08mol,根据元素比例关系得出n(Fe): n(C): n(O): n(H2O) = 0.02mol:0.04mol:0.08mol:0.04mol = 1:2:4:2,X的化学式是FeC2O4·2H2O。
⑵固体X在300℃下与氧气反应生成氧化铁、二氧化碳和水,其反应的化学方程式是4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O;故答案为:4FeC2O4·2H2O+3O2
2Fe2O3+8CO2+8H2O;故答案为:4FeC2O4·2H2O+3O2![]() 2Fe2O3+8CO2+8H2O。
2Fe2O3+8CO2+8H2O。
⑶将热分解后剩余的红棕色继续升温加热至一定温度,可生成1.55g黑色固体(纯净物),质量减少,主要验证黑色固体中是否含有亚铁离子和铁离子,因此实验方案为先取少量黑色固体溶解在盐酸中,分成两支试管,往其中一支里滴加少量KSCN溶液,出现血红色,说明原黑色固体中含Fe3+;往另外一支试管中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀,说明原黑固体中含Fe2+;故答案为:先取少量黑色固体溶解在盐酸中,分成两支试管,往其中一支里滴加少量KSCN溶液,出现血红色,说明原黑色固体中含Fe3+;往另外一支试管中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀,说明原黑固体中含Fe2+。
⑷在隔绝空气加热条件下,该化合物 X 还生成黑色能自燃并且具有铁磁性的粉末即为铁粉,根据氧化还原反应原理分析化合价升降,得到产物为二氧化碳、铁粉和水,其可能发生的化学方程式是FeC2O4·2H2O  Fe+2CO2+2H2O;故答案为:FeC2O4·2H2O
Fe+2CO2+2H2O;故答案为:FeC2O4·2H2O  Fe+2CO2+2H2O。
Fe+2CO2+2H2O。

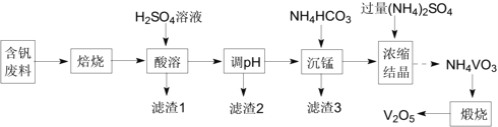
【题目】五氧化二钒(V2O5)在冶金、化工等领域有重要应用。实验室以含钒废料![]() 含V2O3、CuO、MnO、SiO2、Al2O3、有机物
含V2O3、CuO、MnO、SiO2、Al2O3、有机物![]() 为原料制备V2O5的一种流程如图:
为原料制备V2O5的一种流程如图:
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10-20 | 4×10-14 | 1.9×10-33 |
(1)“焙烧”的目的是__;
(2)“滤渣1”的用途为__![]() 写出2种即可
写出2种即可![]() ;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__
;常温下,若“调pH”为7,Cu2+是否能沉淀完全:__![]() 填“是”或“否”
填“是”或“否”![]() ;
;![]() 溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全
溶液中离子浓度小于10-5mol·L-1时,认为该离子沉淀完全![]()
(3)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为__;
(4)结晶所得的NH4VO3需进行水洗、干燥。证明NH4VO3已洗涤干净的实验操作及现象为__;
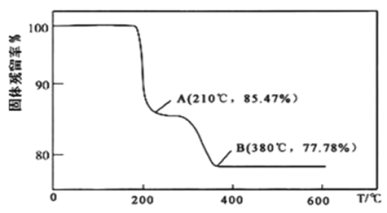
(5)在煅烧NH4VO3生成的V2O5过程中,固体残留率(![]() ×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。
×100%)随温度变化的曲线如图所示。其分解过程中先后失去的物质分别是__、__。![]() 填写分子式
填写分子式![]()
(6)为测定该产品的纯度,兴趣小组同学准确称取V2O5产品2.000g,加入足量稀硫酸使其完全反应,生成(VO2)2SO4,并配成250mL溶液。取25.00mL溶液用0.1000mol·L-1的H2C2O4标准溶液滴定,滴定到终点时消耗标准液10.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+黄色![]() 被还原为VO2+蓝色
被还原为VO2+蓝色![]() ,该反应的离子方程式为__;该产品的纯度为__。
,该反应的离子方程式为__;该产品的纯度为__。