题目内容
【题目】如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
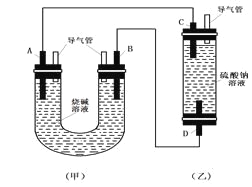
(1)从装置的特点判断,甲、乙装置中___________是原电池,其负极的电极反应式为:_______________;
(2)实验开始后,(乙)装置中有关电极反应是:C:___________________;D:__________________,D电极上的现象是_____________,一段时间后溶液中的现象是________________;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为:__________________,乙装置里除两电极上有明显的现象外,还可以看到的现象是__________________,产生该现象的化学反应方程式是______________。
【答案】甲 Al-3e-+4OH-=AlO2-+2H2O Fe-2e-=Fe2+ 2H++2e-=H2↑ 有无色气体产生 有白色沉淀生成 4OH--4e-=2H2O+O2↑ 白色沉淀转化为灰绿色,最后呈现红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
(1)甲为原电池,乙为电解质,甲中A为正极,B为负极,正极发生还原反应,负极发生氧化反应;
(2)C为阳极,发生氧化反应,D为阴极,发生还原反应;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁。
(1)A、D均为碳棒,B为铝棒,C为铁棒,铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,所以甲为原电池,乙为电解质,甲中A为正极,B为负极,负极发生氧化反应,电极方程式为Al-3e-+4OH-=AlO2-+2H2O;
(2)乙是电解池,其中C为阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+;D为阴极,发生还原反应,电极方程式为2H++2e-=H2↑。氢离子放电破坏水的电离平衡,所以阴极附近溶液碱性增强,所以则可生成氢氧化亚铁白色沉淀,则一段时间后溶液中的现象是有无色气体产生,有白色沉淀生成;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,电极方程式为4OH--4e-=2H2O+O2↑;阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁,可观察到白色沉淀迅速变为灰绿色,最后变为红褐色,产生该现象的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3。
【点晴】
电极产物的判断与有关反应式的书写
1、电解时电极产物的判断——“阳失阴得”,即
 。
。
2、电解池中电极反应式的书写
(1)根据装置书写
①根据电源确定阴、阳两极→确定阳极是否是活性金属电极→据电极类型及电解质溶液中阴、阳离子的放电顺序写出电极反应式。
②在确保阴、阳两极转移电子数目相同的条件下,将两极电极反应式合并即得总反应式。
(2)由氧化还原反应方程式书写电极反应式
①找出发生氧化反应和还原反应的物质→两极名称和反应物→利用得失电子守恒分别写出两极反应式。
②若写出一极反应式,而另一极反应式不好写,可用总反应式减去已写出的电极反应式即得另一电极反应式。

【题目】(1)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:
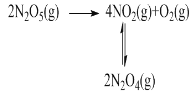
其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解)
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5 | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() =2.9 kPa,则此时的
=2.9 kPa,则此时的![]() =________kPa,v=_______kPa·min1。
=________kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是_________。
④25℃时N2O4(g)= 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。