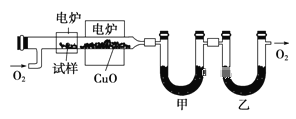
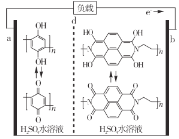
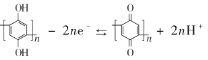
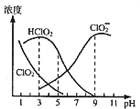
题目内容
【题目】聚酰亚胺是重要的特种工程材料,广泛应用在航空、纳米、激光等领域。某聚酰亚胺的合成路线如图所示(部分反应条件略去):
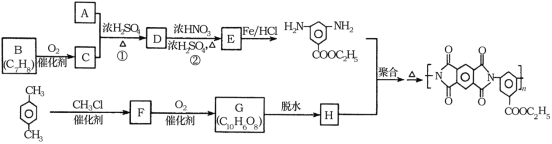
已知:①有机物A的质谱与核磁共振氢谱图如图所示:

②![]()
③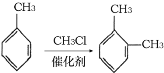
回答下列问题:
(1)A的名称是________________。
(2)反应②的反应类型是________________。
(3)反应①的化学方程式是________________。
(4)F的结构简式是________________。
(5)同时满足下列条件的G的同分异构体共有____种(不含立体结构);写出其中一种的结构简式:________________。
①能发生银镜反应
②发生发生水解反应,其水解产物之一能与FeC13溶液发生显色反应
③1mol该物质最多能与8molNaOH反应
(6)参照上述合成路线,以间二甲苯和甲醇为原料(无机试剂任选)设计制备![]() 的合成路线:__________。
的合成路线:__________。
【答案】乙醇 取代反应 ![]()
![]() 3
3 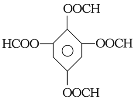
【解析】
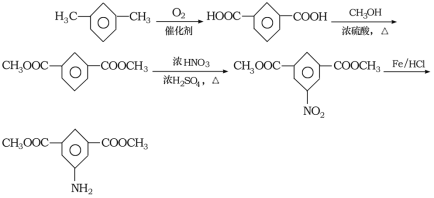
根据已知条件,有机物A的质谱与核磁共振氢谱可知,A的相对原子质量是46,核磁共振氢谱有3组峰,峰面积比为1:2:3,A为乙醇;根据流程,E在Fe和HCl作用下发生还原反应生成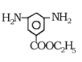 ,则E为
,则E为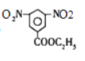 ;E是D反应而来的,D为
;E是D反应而来的,D为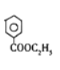 ;D是有A和C在浓硫酸作用下酯化反应得到的,C为
;D是有A和C在浓硫酸作用下酯化反应得到的,C为![]() ;C是有分子式C7H8氧化而来的,B为甲苯,结合③和G的分子式,可知对二甲苯与2分子一氯甲烷反应生成
;C是有分子式C7H8氧化而来的,B为甲苯,结合③和G的分子式,可知对二甲苯与2分子一氯甲烷反应生成![]() ;根据②可知,F氧化生成G
;根据②可知,F氧化生成G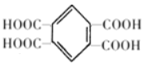 ,G脱水生成H,H为
,G脱水生成H,H为 。
。
(1)根据上述分子可知A为乙醇;
(2)反应②是D在浓硫酸和浓硝酸作用下发生硝化反应生成的E;
(3)反应①还A与C在浓硫酸作用下发生酯化反应生成D,化学方程式为![]() ;
;
(4)F的结构简式是![]() ;
;
(5)同时满足上述3个条件的同分异构体是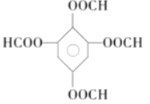 、
、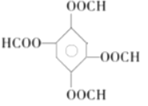 、
、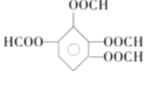 ;
;
(6)间二甲苯氧化生成间苯二甲酸,间苯二甲酸与甲醇发生酯化反应生成间苯二甲酸二甲酯,间苯二甲酸二甲酯发生硝化反应生成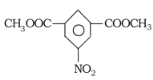 ,
, 还原得到目标产物,合成路线为:
还原得到目标产物,合成路线为: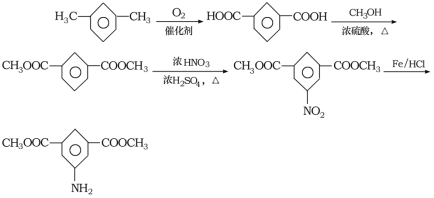 。
。

【题目】在800℃2L密闭容器中,反应2NO+O2![]() 2NO2,n(NO)随时间的变化如下表:
2NO2,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)如图表示各物质浓度的变化曲线。

A点处,v(正)__v(逆),A点正反应速率__B点正反应速率。(用“>”、“<”、“=”填空)
(2)图中表示O2变化的曲线是__。用NO2表示从0~2s内该反应的平均速率v=__。
(3)能使该反应的反应速率增大的是__。
A.及时分离出NO2气体 B.升高温度
C.减小O2的浓度 D.选择高效的催化剂
(4)能说明该反应已经达到平衡状态的是__。
A.容器内压强保持不变 B.v(NO)=2v(O2)
C.容器内的密度保持不变 D.v逆(NO2)=2v正(O2)