题目内容
8.已知Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O把下列四种Na2S2O3溶液分别加入四个盛有10mL 2mol/L硫酸的锥形瓶中,并加水稀释到50mL,其中出现浑浊最快的是( )| A. | 20℃,20mL、3mol/L的Na2S2O3溶液 | B. | 10℃,10mL、4mol/L的Na2S2O3溶液 | ||
| C. | 10℃,30mL、2mol/L的Na2S2O3溶液 | D. | 20℃,10mL、4mol/L的Na2S2O3溶液 |
分析 由数据可知,有温度、浓度影响反应速率,浓度越大、温度越大,则反应速率越快,以此来解答.
解答 解:由数据可知,20℃>10℃,则A、D 的反应速率大于B、C中的反应速率,
又A中Na2S2O3的物质的量比D大,又最终都稀释到50mL,所以A中Na2S2O3的浓度大,则A中反应速率大于D中反应速率,
所以A中反应速率最大,
故选A.
点评 本题考查影响反应速率的因素,注意浓度、温度的比较即可解答,明确温度、浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
相关题目
18.要加快H2O2分解的速度,下列措施不可行的是( )
| A. | 加热或光照 | B. | 加MnO2或FeCl3 | C. | 加压 | D. | 增大H2O2的浓度 |
19.下列关于化学反应中的能量变化的表述正确的是( )
| A. | 加热才能发生的反应一定是吸热反应 | |
| B. | 断开化学键的过程会吸收能量 | |
| C. | 化学能不仅可以与热能相互转化,还可以与电能相互转化 | |
| D. | 燃烧可能为吸热反应 |
16.可以证明某化合物一定含有离子键的性质是( )
| A. | 熔融状态能导电 | B. | 具有较高的熔点 | C. | 可溶于水 | D. | 溶于水能导电 |
3.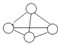 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )(NA表示阿佛加德罗常数的值 磷的相对原子质量P-31)
| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
2. 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B的可能组成是SO2、H2中的一种或两种.
【实验探究】
实验室提供下列试剂:0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2溶液、淀粉溶液、蒸馏水.在配制0.01mol/L酸性KMnO4溶液溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100ml容量瓶和胶头滴管(填仪器名称).
请你完成以下探究实验.
【问题讨论】某同学认为把上述装置中乙部分酸性高锰酸钾溶液改为品红溶液,也可以达到同样的目的.
 铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.
铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将铁与一定量的浓硫酸加热时,观察到铁完全溶解得到溶液A,并产生大量气体B.【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种.
Ⅱ.所得气体B的可能组成是SO2、H2中的一种或两种.
【实验探究】
实验室提供下列试剂:0.01mol/L酸性KMnO4溶液、0.1mol/L KSCN溶液、3%H2O2溶液、淀粉溶液、蒸馏水.在配制0.01mol/L酸性KMnO4溶液溶液过程中,需要用到的玻璃仪器是烧杯、玻璃棒、100ml容量瓶和胶头滴管(填仪器名称).
请你完成以下探究实验.
| 实验操作 | 预期现象 | 结 论 | |
| 验证猜想Ⅰ | ①取适量A溶液,滴加0.1mol/LKSCN溶液 ②另取适量A溶液,滴加少量0.01mol/L酸性KMnO4溶液 | ①酸性高锰酸钾溶液褪色,说明含有亚铁离子; ②溶液变为血红色 | 含有Fe2+和Fe3+ |
| 验证猜想Ⅱ | 将所得气体通入下图所示装置 | 甲中紫色褪去,乙中不褪色,试管中收集到气体 | 含有两种气体 |
20.按碳骨架分类,下列说法正确的是( )
| A. | 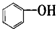 属于醇类化合物 属于醇类化合物 | B. | 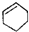 属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH3CH(CH3)2属于链状化合物 | D. | 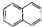 属于脂环化合物 属于脂环化合物 |

 .
. .
.