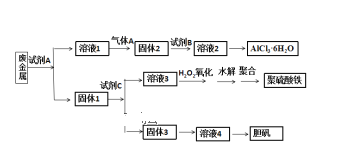
题目内容
【题目】下列操作正确且能达到实验目的是( )
A.制取氢氧化亚铁并观察其颜色
B.制备无水氯化镁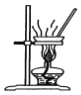
C.比较两种物质的热稳定性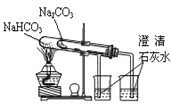
D.制取收集干燥纯净NH3
【答案】A
【解析】
A. 氢氧化亚铁具有还原性,易被氧气氧化,因此在制备时,胶头滴管需要伸入液面以下,且为防止氧气氧化,液面用煤油液封,该装置可达到实验目的,A项正确;
B. 氯化镁溶液容易发生水解,直接加热蒸发氯化镁溶液,水解产生的HCl受热挥发,使得平衡不断向右移动,最终会得到氢氧化镁固体,得不到无水氯化镁,B项错误;
C. 比较两种物质的热稳定性,装置图中大试管应装碳酸钠,小试管温度低,应加碳酸氢钠,这样才能形成对比,得出碳酸氢钠不稳定受热易分解的结论,C项错误;
D. 氨气的密度比空气小,应使用向下排气法,该实验装置不能达到实验目的,D项错误;
答案选A。

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
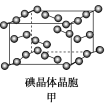
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。
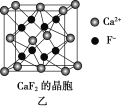
(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。