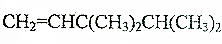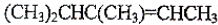题目内容
14.如图为某原电池的示意图,下列说法正确的是( )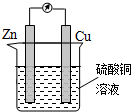
| A. | 铜片作负极 | B. | 溶液的颜色逐渐变浅 | ||
| C. | 电子由铜棒流出 | D. | 锌片上发生还原反应 |
分析 该装置中,锌易失电子作负极,铜作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:A.该装置中锌易失电子作负极,铜作正极,故A错误;
B.铜作正极,正极上溶液中的铜离子得电子发生还原反应,所以溶液的颜色逐渐变浅,故B正确;
C.电子从负极沿导线流向正极,即电子从负极锌沿导线流向正极铜,故C错误;
D.锌失电子发生氧化反应而作负极,故D错误;
故选B.
点评 本题考查了原电池原理,根据电极上得失电子判断正负极,再结合电极反应类型、电子流向来分析解答,熟记原电池原理,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
4.下列仪器的使用或操作或实验正确的是( )
| A. | 测定溶液pH的操作:将pH试纸置于表面皿上,用蒸馏水润湿,再用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 | |
| B. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| C. | 测定空气中甲醛含量,使50mL注射器充满空气,通入到2mL2×10-4mol/L用硫酸酸化的高锰酸钾溶液中,重复前面的操作直到紫红色褪去,记录消耗空气体积,即可粗略测定空气中甲醛含量 | |
| D. | 做Al与CuSO4溶液的置换反应实验时,可将铝条直接插入CuSO4溶液中,观察铝片表面是否有铜析出 |
5.下列物质间的反应能用H++OH-═H2O表示的是( )
| A. | 醋酸和氢氧化钠 | B. | 盐酸和氨水 | ||
| C. | 硫酸和氢氧化钾 | D. | 碳酸氢钠和氢氧化钠 |
9.下列实验现象与结论不一致的是
( )
| 实验操作(或设计) | 实验现象 | 结论 | |
| A | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | 酸性:HB>HA |
| B | 以镁、铝、氢氧化钠溶液构成原电池 | 镁表面有气泡 | 镁作原电池的负极 |
| C | 相同温度下,等质量的大理石与等体积等浓度的盐酸反应 | 粉状大理石产生气泡更快 | 反应速率: 粉状大理石>块状大理石 |
| D | 向盛有10滴0.1mol•L-1 AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 NaI溶液 | 先有白色沉淀,后转成黄色沉淀 | Ksp(AgCl )>Ksp (AgI) |
| A. | A | B. | B | C. | C | D. | D |
19.如图示意图与对应的反应情况正确的是( )
| A. |  向AgNO3和CuCl2的混合溶液中缓慢通入氨水溶液 | |
| B. |  向NaOH和Ca(OH)2的混合溶液中通入CO2 | |
| C. | 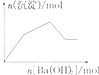 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 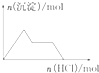 NaAlO2溶液中逐滴加入盐酸 |
6.根据下面的信息,下列叙述不正确的是( )


| A. | 化学键的断裂和行成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2 反应生成1mol H2O释放能量一定为245kJ | |
| D. | 2mol H2(g)跟1mol O2 (g)反应生成2mol H2O(g)释放能量490kJ |
7.下列物质中,能使酸性高锰酸钾溶液褪色的是( )
| A. | CH4 | B. | CH2=CH2 | C. | CH3CH3 |
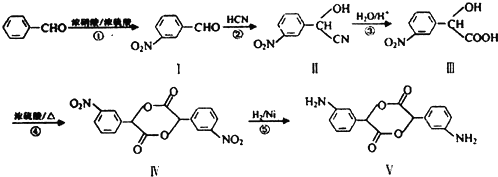
 和
和 .
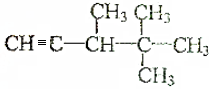
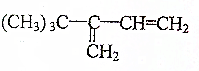
.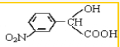 →
→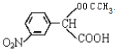 +H2O(不要求写出反应条件);用丙酮(
+H2O(不要求写出反应条件);用丙酮( 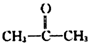 )代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.
)代替化合物I发生反应②、反应③可以得到化合物Ⅵ(生产有机玻璃的中间体),化合物Ⅵ的结构简式为CH3CHOH(CH3)COOH.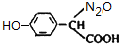 .
.