题目内容
12.X、Y、Z、W、M均为短周期元素且原子序数依次增大,X、M同主族;Z+、W3+与Y2-具有相同的电子层结构;M 是地壳中含量占第二的元素.下列说法正确的是( )| A. | 原子最外层电子数:X>Y>Z | B. | 粒子半径:r(W3+)>r(Y2-)>r(Z+) | ||
| C. | MY2与Z2Y的化合物类型相同 | D. | 单质沸点:M>Z>Y |
分析 X、Y、Z、W、M均为短周期元素且原子序数依次增大,X、M同主族,M 是地壳中含量占第二的元素,则M为Si、X为C;Z+、W3+与Y2-具有相同的电子层结构,可推知Y为O、Z为Na、W为Al,据此解答.
解答 解:X、Y、Z、W、M均为短周期元素且原子序数依次增大,X、M同主族,M 是地壳中含量占第二的元素,则M为Si、X为C;Z+、W3+与Y2-具有相同的电子层结构,可推知Y为O、Z为Na、W为Al.
A.X(C)、Y(O)、Z(Na)最外层电子数依次为4、6、1,故A错误;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+)>r(Al3+),故B错误;
C.SiO2属于原子晶体,Na2O属于离子晶体,故C错误;
D.常温下,氧元素单质为气体,则Na为金属晶体,Si为原子晶体,故单质沸点:M>Z>Y,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意理解掌握熔沸点高低的比较.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案
相关题目
2.硫酸工业用SO2制取SO3的反应为:2SO2+O2 $?_{加热}^{催化剂}$2SO3 将2molSO22mol O2加入容积为5L的带有活塞的密闭器中,在一定条件下达到平衡.不同温度下,反应的平衡常数如右表,且在温度为T1、T2时,平衡体系中SO2的体积分数随压强变化曲线如图1所示.
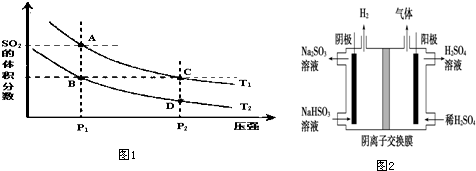
(1)比较K值的大小,K1<K2(填>、=、<).
(2)下列说法正确的是CD
A.A、C两点的正反应速率:A>C
B.A、C两点SO2气体的浓度:A>C
C.B、C两点的气体的平均相对分子质量:B=C
D.由状态D到状态C,可以用加热的方法
(3)在500℃时,若保持容积不变,每隔一定时间就对该容器内的物质进行分析,得到如下表的部分数据:
①在上述条件下,从反应开始直至60s时,二氧化硫的平均反应速率为0.0006mol•(L•s)-1.
②该条件下反应的平衡常数K的值为368.2(精确到小数点后一位).
(4)工业上用Na2SO3吸收尾气中的SO2使之转化为NaHSO3,再用图2装置电解(惰性电极)NaHSO3制取H2SO4,该电解池阴极的总电极反应式2HSO3-+2e-═SO32-+H2↑,阳极室除生成硫酸外,还有少量的SO2 和O2生成.则阳极发生的副反应的电极反应式为2SO32-+4e-═2SO2↑+O2↑,该工艺中可循环利用的物质是Na2SO3、H2SO4、SO2(填化学式).

(1)比较K值的大小,K1<K2(填>、=、<).
(2)下列说法正确的是CD
A.A、C两点的正反应速率:A>C
B.A、C两点SO2气体的浓度:A>C
C.B、C两点的气体的平均相对分子质量:B=C
D.由状态D到状态C,可以用加热的方法
(3)在500℃时,若保持容积不变,每隔一定时间就对该容器内的物质进行分析,得到如下表的部分数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(SO2)/mol | 2.00 | 0.60 | |||
| n(SO3)/mol | 0.00 | 0.80 | 1.8 | 1.8 |
②该条件下反应的平衡常数K的值为368.2(精确到小数点后一位).
(4)工业上用Na2SO3吸收尾气中的SO2使之转化为NaHSO3,再用图2装置电解(惰性电极)NaHSO3制取H2SO4,该电解池阴极的总电极反应式2HSO3-+2e-═SO32-+H2↑,阳极室除生成硫酸外,还有少量的SO2 和O2生成.则阳极发生的副反应的电极反应式为2SO32-+4e-═2SO2↑+O2↑,该工艺中可循环利用的物质是Na2SO3、H2SO4、SO2(填化学式).
3.下列各表述与示意图一致的是( )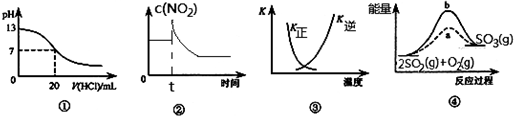

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
17.从海水中提取镁,主要步骤如图所示:下列说法不正确的是( )
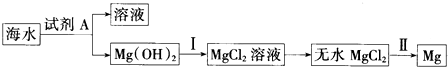

| A. | 试剂A为石灰乳,价格低廉,可来自贝壳 | |
| B. | 操作Ⅰ中加入的试剂为盐酸 | |
| C. | 以上提取镁的过程中没有涉及氧化还原反应 | |
| D. | 操作Ⅱ的条件为电解 |
4.“绿色化学”是当今社会提出的一个新概念.在“绿色化学”工艺中.理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
1.下列说法不正确的是( )
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
 溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯及检验溴与苯发生了取代反应的装置示意图及有关数据如下: 、
、 ;
; ;
;