题目内容
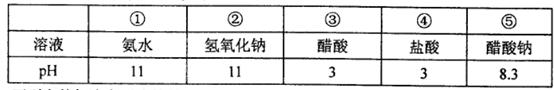
常温下,下列溶液的pH或微粒的物质的量浓度关系正确的是
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:2c(OH—)=2c(H+)+c(HA)-c(A—)
B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2—)+c(HR—)=c(Na+)
D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则该溶液的pH一定为14-a
A
试题分析:A.将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后得到的溶液为HA与NaA按照1:1的混合溶液。由于混合溶液的pH大于7,则说明A-的水解作用大于HA的电离作用。根据电荷守恒可得:c(H+)+ c(Na+)= c(OH—)+ c(A—)。根据物料守恒可得:c(HA)+c(A—)=2c(Na+)。两式联立求解可得:2c(OH—)=2c(H+)+c(HA)-c(A—)。正确。B.某溶液中存在的离子有S2—、HS—、OH—、Na+、H+,若为Na2S溶液,则离子浓度的大小关系一定是:c(Na+)>c(S2—)>c(OH—)>c(HS—)>c(H+)。若为NaHS溶液,则离子浓度的大小关系一定是:c(Na+) >c(HS—) >c(OH—)>c(S2—) > c(H+)。错误。C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,根据物料守恒可得则反应后的混合液:2c(R2—)+c(HR—)=c(Na+)。错误。D.某物质的溶液中由水电离出c(H+)=1×10—amol/L,若a>7时,则水的电离受到了抑制,该溶液可能呈酸性,也可能呈碱性。若为酸性该溶液的pH为14-a;若为碱性,则pH=a.错误。

练习册系列答案
相关题目