题目内容
将0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10rnL混合后,溶液显酸性,则溶液中有关微粒的浓度关系正确的是
| A.c (Ac-)>c (Cl-)>c (H+)> c (HAc) | B.c (Na+)+c (H+)=c (Ac-)+c (Cl-) |
| C.c (Ac-)=c (Cl-)>c (H+)>c (HAc) | D.c (Ac-)>c (Cl-)>c (HAc)>c(H+) |
D
试题分析:反应后的溶液为HAc与HCl按照1:1的物质的量的比的混合溶液。由于溶液显酸性,说明在溶液中HAc的电离作用大于Ac-的水解作用。所以c (Ac-)>c (Cl-)>c (HAc),但是HAc是弱酸,电离程度是很微弱的,所以c (HAc)>c (H+),因此关系为c (Ac-)>c (Cl-)>c (HAc)>c (H+)。A.错误。D正确。根据电荷守恒可得:c (Na+)+c (H+)=c (Ac-)+c (Cl-)+c(OH-)。B.错误。根据物料守恒可得 c (Ac-)=c(Na+)="c" (Ac-)+c (HAc)。C.错误。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
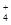 )之和
)之和 2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是
2C(g)若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法中正确的是