题目内容
部分弱酸的电离平衡常数如下表:
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,
c(NH4HCO3)>c(NH4CN) >c(HCOONH4)
BC
试题分析:A、氢氰酸的电离平衡常数小于碳酸而大于碳酸氢根离子,所以氢氰酸酸性小于碳酸而大于碳酸氢根离子,根据强酸制取弱酸知碳酸和氰化物的盐反应生成氢氰酸和碳酸氢盐,离子方程式为CN-+H2O+CO2═HCN+HCO3-,错误;B、因为HCOOH的电离平衡常数大于HCN的电离平衡常数,所以等pH的HCOOH和HCN,HCN的浓度大,因此中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,正确;C、根据物料守恒可得两溶液分别存在:c(Na+)-c(HCOO-)=c(HCOOH),c(K+)-c(CN-)=c(HCN),根据越弱越水解的规律,c(HCOOH)< c(HCN),则c(Na+)-c(HCOO-) < c(K+)-c(CN-),正确;D、根据越弱越水解的规律,c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4CN) > c(NH4HCO3) c(HCOONH4),错误。

练习册系列答案
相关题目
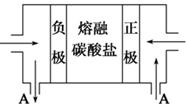
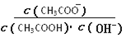 不变
不变