题目内容
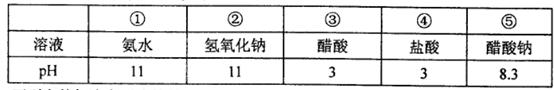
现有常温下的五种溶液(如下表)。
下列有关叙述中正确的是

下列有关叙述中正确的是
| A.五种溶液中,水电离出的c(OH-)最小的是⑤ |
| B.将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)> c(OH-)。 |
| C.分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>③>④ |
| D.在⑤中加入适量的④至溶液呈中性,所得溶液中:c(Na+)>c(CH3COO-)> c(Cl-)>c(OH-)= c(H+)。 |
D
试题分析:A.五种溶液中,①、②、③、④都是对水的电离起抑制作用,而且抑制的程度相同,但是⑤是强碱弱酸盐,对水的电离起促进作用,所以水电离出的c(OH-)最大的是⑤。错误。B.氨水是弱碱,盐酸是强酸。若将①、④两种溶液等体积混合,由于碱过量,所以所得溶液是NH4Cl与NH3·H2O的混合溶液。由于NH3·H2O的电离作用大于NH4Cl的水解作用。所以c(NH4+)>c(Cl-).电离使溶液显碱性,所以c(OH-)>c(H+).盐的电离大于弱电解质的电离作用,因此c(Cl-)>c(OH-)。所以溶液中的两种浓度关系为c(NH4+)>c(Cl-)> c(OH-)>c(H-)。错误。C.①、③是弱电解质,加水稀释时pH变化较小,而②、④是强电解质,加水稀释时pH变化较大。若将这四种溶液加水稀释100倍,稀释后四种溶液的pH:①>②>④>③。错误。D.在⑤中加入适量的④至溶液呈中性,所得溶液是NaCl、CH3COONa、CH3COOH的混合溶液。由于加入的HCl量较小,所以离子浓度关系是c(Na+)>c(CH3COO-)> c(Cl-)>c(OH-)= c(H+)。正确。

练习册系列答案
相关题目

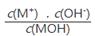 不变
不变