题目内容
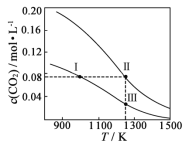
【题目】能源是人类生存和发展的重要支柱。研究和有效地开发新能源有重要意义。已知 CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的燃烧过程如图所示:
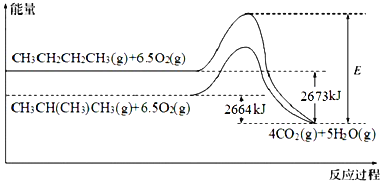
已知:H2O(g)=H2O(l) ΔH=-41kJ·mol-1。请根据以上信息,回答下列有关问题:
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的_____。
(2)CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性_____更高。
(3)表示CH3CH(CH3)CH3(g)燃烧热的热化学方程式为_____。
(4)CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为_____
(5)如表所示是部分化学键的键能参数(已知CO的结构式为C≡O):
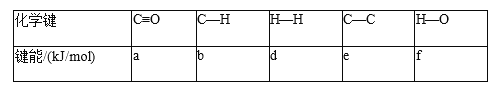
合成气(CO 和 H2 的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),则合成 1molCH3CH2CH2CH3(g)的 ΔH=__。
【答案】活化能 CH3CH(CH3)CH3 CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l)ΔH =-2869kJ·mol-1 CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) ΔH =-9kJ·mol-1 [(4a+9d)-(3e+10b+8f)]kJ·mol-1
【解析】
(1)E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的活化能;
(2)物质的能量越低越稳定;
(3)燃烧热是指可燃物完全燃烧生成稳定氧化物放出的热量,结合盖斯定律分析书写;
(4)根据图像有①CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2673kJmol-1,②CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2664kJmol-1,根据盖斯定律分析书写CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式;
(5)根据反应的焓变△H=反应物键能总和-生成物键能总和计算。
(1)图形中 E 表示 CH3CH2CH2CH3(g)燃烧反应逆反应的活化能,故答案为:活化能;
(2)根据图象可知,CH3CH2CH2CH3(g)的能量比CH3CH(CH3)CH3(g)高,则CH3CH2CH2CH3(g)与 CH3CH(CH3)CH3(g)的热稳定性:CH3CH(CH3)CH3>CH3CH2CH2CH3,故答案为:CH3CH(CH3)CH3;
(3)根据图像有①CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g)△H=-2664kJmol-1,②H2O(g)=H2O(l)△H=-41kJmol-1,根据盖斯定律,将①+②×5得到表示 CH3CH(CH3)CH3(g)燃烧热的热化学方程式为:CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJmol-1,故答案为:CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l) △H=-2869kJmol-1;
(4)根据图像有①CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g) △H=-2673kJmol-1,②CH3CH(CH3)CH3(g)+6.5O2(g)→4CO2(g)+5H2O(g) △H=-2664kJmol-1,根据盖斯定律,将①-②得到CH3CH2CH2CH3(g)转化为 CH3CH(CH3)CH3(g)的热化学反应方程式为:CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) △H=-9kJmol-1,故答案为:CH3CH2CH2CH3(g)→CH3CH(CH3)CH3(g) △H=-9kJmol-1;
(5)合成气(CO 和 H2的混合气体)可以合成 CH3CH2CH2CH3(g),同时生成 H2O(g),化学方程式为:4CO(g)+9H2(g)→CH3CH2CH2CH3(g)+4H2O(g),反应的焓变△H=反应物键能总和-生成物键能总和,则合成 1molCH3CH2CH2CH3(g)的△H=[(4a+9d)-(3e+10b+8f)]kJmol-1,故答案为:[(4a+9d)-(3e+10b+8f)]kJmol-1。