题目内容
13. 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是(任填一种即可)明矾(硫酸铝,硫酸铁,硫酸亚铁),其净水作用的原理是铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的.
(2)水的混凝法净化与硬水的软化的区别是水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子.
(3)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO).若某天然水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6.0×10-4mol/L,则此水的硬度为10°.
(4)若(3)中的天然水中c(HCO3-)=8.0×10-4mol/L,现要将10m3这种天然水中的Ca2+和Mg2+完全除去,则需先加入Ca(OH)2740g,后加入Na2CO31484g.
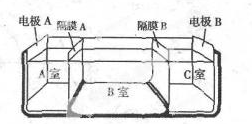
(5)如图是电渗析法淡化海水的原理图,其中电极A接直流电源的正极,电极B接直流电源的负极.
①隔膜A是阴(填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大 量的Na+、Cl-,以及少量的K+、SO42-.若用上述装置对该海水进行淡化,当淡化工作完成后,A,B,C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为pHa<pHb<pHc.
分析 (1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;
(2)净化水是除去悬浮杂质,软化水是除去钙镁离子;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子.;
(5)阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电;根据电极反应来书写总的电解反应.
解答 解:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,水解方程式为Al3++3H2O?Al(OH)3+3H+,明矾,硫酸铝,硫酸铁,硫酸亚铁也可以起到净水的作用,铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
故答案为:明矾(硫酸铝,硫酸铁,硫酸亚铁);铝盐或铁盐在水中发生水解生成相应的氢氧化物胶体,它可吸附天然水中悬浮物并破坏天然水中的其他带异电的胶体,使其聚沉达到净水的目的;
(2)水的净化是除去悬浮性杂质,一般用明矾进行;水的软化是降低Ca2+、Mg2+的浓度,方法很多,有离子交换法、石灰纯碱法等,
故答案为:水的净化是用混凝剂(如明矾等)将水中胶体及悬浮物沉淀下来,而水的软化是除去水中的钙离子和镁离子;
(3)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°;
故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol•L-1=12mol;镁离子物质的量=10×103L×6×10-4mol•L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol•L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,
故答案为:740;1484;
(5)①电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,故答案为:阴;
②电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,故答案为:pHa<pHb<pHc.
点评 本题考查了盐类水解的应用,净水方法和软化原理,水的硬度计算需要理解题干信息,准确计算,题目难度中等.

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案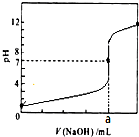 常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )
常温下,用0.1000mol/LNaOH溶液滴定20.00mL 0.1000mol/LHCl溶液,滴定曲线,如图所示.下列说法不正确的是( )| A. | a=20.00 | |
| B. | 滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 | |
| D. | 若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a<20.00 |
| A. | 参加反应所需NaOH与氯气的物质的量之比一定为2:1 | |
| B. | 反应体系中n(NaCl):n(NaClO):n(NaC1O3)(物质的量之比)可能为11:1:2 | |
| C. | 若反应有amol氯气参加反应,则amol<转移电子数<$\frac{5a}{3}$mol | |
| D. | 反应中NaC1O和NaClO3为氧化产物,且物质的量之比一定为l:1 |
| A. | 此纯碱溶液中含有CO${\;}_{3}^{2-}$的数目为aNA | |
| B. | 若a<b<2a,生成标准状况下二氧化碳的体积可能是11.2b L或22.4(b-a)L | |
| C. | 若b≥2a,则两溶液相互滴加的顺序不同,反应生成的二氧化碳分子数目不同 | |
| D. | 若b≤a,则无论两溶液相互滴有加的顺序如何,反应过程中均有气泡产生 |
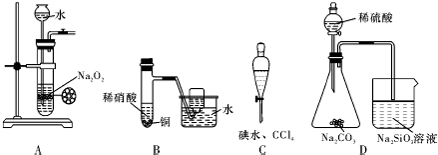
| A. | 制备少量氧气 | B. | 制备并收集少量NO气体 | ||
| C. | 四氯化碳萃取碘水中的碘 | D. | 证明非金属性强弱:S>C>Si |

| A. | 甲是乙烯 | B. | 乙可能是葡萄糖 | ||
| C. | 丙与NaOH溶液反应不能生成乙醇 | D. | 丁十H2→乙醇的反应属于加成反应 |
| A. | 其他条件不变,增大压强,平衡不发生移动 | |
| B. | 其他条件不变,增大压强,混合气体的总质量不变 | |
| C. | 该反应式中n值一定为2 | |
| D. | 原混合气体中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
| A. | 甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应 | |
| B. | 乙烯能使酸性高锰酸钾溶液和溴水褪色,二者反应原理相同 | |
| C. | 糖类、油脂和蛋白质都是高分子化合物,都能发生水解反应 | |
| D. | 蛋白质、人造纤维和光导纤维都属于有机高分子化合物 |
 我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品.
我国黄铁矿(主要成分:FeS2、SiO2)储量丰富,目前主要利用黄铁矿资源生产硫酸等无机化工产品. ①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;
①烧渣用稀硫酸浸取时有单质硫生成,生成单质硫的一步化学反应方程式为H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;