题目内容
【题目】写出符合下列要求的离子方程式:
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合_________________;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合____________________;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合____________________;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应______________________________;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应______________________________。
【答案】Ca2++![]() +OH-=CaCO3↓+H2O Ca2++
+OH-=CaCO3↓+H2O Ca2++![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O ![]() + Ba2++OH-=BaCO3↓+H2O Ca2++
+ Ba2++OH-=BaCO3↓+H2O Ca2++![]() +OH-=CaCO3↓+H2O Ca2++2
+OH-=CaCO3↓+H2O Ca2++2![]() +2OH-=CaCO3↓+2H2O+
+2OH-=CaCO3↓+2H2O+![]()
【解析】
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合生成碳酸钙沉淀、碳酸氢钠和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合生成碳酸钙沉淀和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合生成碳酸钡沉淀、氢氧化钠和水,离子方程式为:![]() + Ba2++OH-=BaCO3↓+H2O;
+ Ba2++OH-=BaCO3↓+H2O;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应生成碳酸钙沉淀、氢氧化钠和水,离子方程式为:Ca2++![]() +OH-=CaCO3↓+H2O;
+OH-=CaCO3↓+H2O;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应,生成碳酸钙沉淀、碳酸钠和水,离子方程式为:Ca2++2![]() +2OH-=CaCO3↓+2H2O+
+2OH-=CaCO3↓+2H2O+![]() 。
。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 304 | 670 |
沸点/℃ | 132 | 173 | 316,易升华 | 700 |
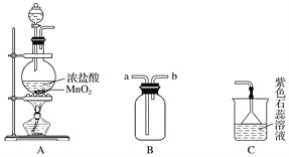
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原少量无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为B→A→___→___→___→E(填字母,装置可多次使用);A中长颈漏斗的作用_____________。
③C中盛放的试剂是_____________。
(2)利用反应2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
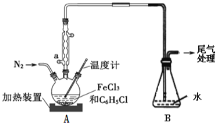
①仪器a的作用是__________。
②反应中提供过量氯苯的作用是__________。
③反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250 mL,量取25.00 mL所配溶液,用0.400 mol/L的NaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
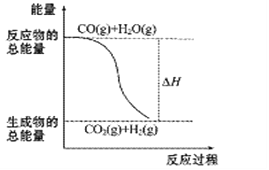
【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为: 。
(2)今有如下两个热化学方程式:则a b(填“>”、“=”或“<”)
H2(g)+ 1/2O2(g)=H2O(g) ΔH1=a kJ·mol-1
H2(g)+ 1/2O2(g)=H2O(l) ΔH2=b kJ·mol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a的值:_______________(注明“+”或“-”)。
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。利用水煤气合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)![]() CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)![]() CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)![]() CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)![]() CH3OCH3(g) + CO2(g)的ΔH= ;
CH3OCH3(g) + CO2(g)的ΔH= ;