题目内容
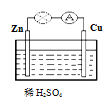
【题目】把2mol钠和1mol铝的混合物小心地投入932g水中,充分反应,计算:
(1)生成气体的质量为多少______?
(2)溶液中有几种溶质______?
(3)各溶质的质量分数为多少______?
【答案】5g 氢氧化钠和偏铝酸钠两种溶质 4%、8.2%
【解析】
把2mol钠和1mol铝的混合物小心地投入932克水中,由2Na+2H2O═2NaOH+H2↑,可知生成2molNaOH、1mol氢气,由2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知NaOH有剩余,Al完全反应,反应后溶液中溶质为NaOH、NaAlO2,可知生成1molNaAlO2,1.5mol氢气,消耗1molNaOH,溶液中NaOH为1mol,根据m=nM计算氢气质量,计算溶液中NaOH、NaAlO2的质量,溶液质量=金属质量+水的质量-氢气质量,进而计算质量分数。
由2Na+2H2O=2NaOH+H2↑可知,2molNa反应生成2molNaOH、1mol氢气,由2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知NaOH有剩余,Al完全反应,反应后溶液中溶质为NaOH、NaAlO2,
2Al+2NaOH+2H2O═2NaAlO2+3H2↑
2 2 2 2 3
1mol1mol1mol1 mol 1.5mol
(1)故生成氢气质量为(1mol+1.5mol)×2g/mol=5g;
故答案为:5g;
(2)根据上述分析,可知NaOH有剩余,Al完全反应,反应后溶液中溶质为NaOH、NaAlO2,
故答案为:氢氧化钠和偏铝酸钠两种溶质;
(3)根据质量守恒定律,溶液的质量等于参加反应的各物质的质量总和减去氢气的质量,溶液质量=2mol×23g/mol+1mol×27g/mol+932g5g=1000g;溶液中NaAlO2为1mol,故NaAlO2的质量分数为![]() ×100%=8.2%;溶液中NaOH为2mol1mol=1mol,故NaOH的质量分数=
×100%=8.2%;溶液中NaOH为2mol1mol=1mol,故NaOH的质量分数=![]() ×100%=4%;
×100%=4%;
故答案为:NaAlO2的质量分数为8.2%、NaOH的质量分数为4%。

 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】温度为T1时,向容积为2 L 的密闭容器甲、乙中分别充入一定量的CO(g)和H2O(g),发生反应:CO(g) + H2O(g) ![]() CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
CO2(g) + H2(g) H = -41 kJ/mol。数据如下,下列说法不正确的是
容器 | 甲 | 乙 | ||
反应物 | CO | H2O | CO | H2O |
起始时物质的量(mol) | 1.2 | 0.6 | 2.4 | 1.2 |
平衡时物质的量(mol) | 0.8 | 0.2 | a | b |
A. 甲容器中,平衡时,反应放出的热量为16.4 kJ
B. T1时,反应的平衡常数K甲 = 1
C. 平衡时,乙中CO的浓度是甲中的2倍
D. 乙容器中,平衡时CO的转化率约为75%