题目内容
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 304 | 670 |
沸点/℃ | 132 | 173 | 316,易升华 | 700 |
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

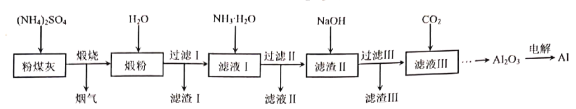
①H2还原少量无水FeCl3制取FeCl2的化学方程式为_____________。
②按气流由左到右的方向,上述仪器的连接顺序为B→A→___→___→___→E(填字母,装置可多次使用);A中长颈漏斗的作用_____________。
③C中盛放的试剂是_____________。
(2)利用反应2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,反应开始前先通N2一段时间,控制反应温度在一定范围加热3 h,反应完成后继续通一段时间N2至装置冷却后,分离提纯得到粗产品。
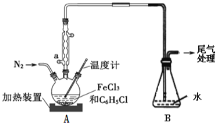
①仪器a的作用是__________。
②反应中提供过量氯苯的作用是__________。
③反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是____,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250 mL,量取25.00 mL所配溶液,用0.400 mol/L的NaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为__________。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl C D C 平衡压强,便于观察装置是否有堵塞 碱石灰 冷凝回流,防止有机物挥发 促进反应正向进行,提高FeCl3的转化率 苯 蒸馏滤液 78.4%
2FeCl2+2HCl C D C 平衡压强,便于观察装置是否有堵塞 碱石灰 冷凝回流,防止有机物挥发 促进反应正向进行,提高FeCl3的转化率 苯 蒸馏滤液 78.4%
【解析】
(1)H2还原无水FeCl3制取FeCl2,用B装置H2,用A观察H2的流速并平衡气压,用C装置中的碱石灰干燥H2,干燥后的H2与无水FeCl3在D中发生反应:H2+2FeCl3![]() 2FeCl2+2HCl,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气;
2FeCl2+2HCl,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气;
(2)在A三颈烧瓶中放入32.5 g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3 h,发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+3C6H4Cl2+HCl↑,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,以此解答该题。
2FeCl2+3C6H4Cl2+HCl↑,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,以此解答该题。
(1)①H2还原无水FeCl3制取FeCl2的反应为:H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
②用B装置H2,用A观察H2的流速并平衡气压,A中长颈漏斗可以平衡压强,同时也便于观察装置是否有堵塞;用C装置干燥H2,干燥后的H2与无水FeCl3在D中发生反应,为防止外界空气中的水蒸气进入D装置,D之后再连接一个C,最后用E装置处理尾气,故按气流由左到右的方向,上述仪器的连接顺序为:BACDCE;A中长颈漏斗的作用是平衡压强,便于观察装置是否有堵塞;
③C的目的是干燥H2,用以吸收H2中的水蒸气,其盛放的试剂是碱石灰;
(2)①仪器a为球形冷凝管,其作用是冷凝回流,防止有机物挥发;
②在装置A会发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑,在反应中使用过量的氯苯,可以促进反应正向进行,提高FeCl3的转化率;
2FeCl2+C6H4Cl2+HCl↑,在反应中使用过量的氯苯,可以促进反应正向进行,提高FeCl3的转化率;
③反应结束后,冷却实验装置A,三颈烧瓶内物质主要是产物FeCl2,还有过量的氯苯及副产物C6H4Cl2,由题可知,氯苯和副产物C6H4Cl2易溶于苯、乙醇而不溶于水,FeCl2不溶于苯、C6H5Cl、C6H4Cl2,,易溶于水和乙醇,易吸水,故洗涤所用的试剂可以是苯;回收滤液中C6H5Cl的操作方法是蒸馏滤液,并收集沸点132℃的馏分;
④根据Fe元素守恒,可知32.5 g无水氯化铁理论上生成FeCl2的物质的量为:n(FeCl2)=n(FeCl3)=![]() =0.2 mol,HCl消耗标准液NaOH的物质的量n(NaOH)=0.400 mol/L ×0.0196 L=7.84×10-3 mol,故根据反应方程式中物质转化关系可知反应生成的n(FeCl2)=2n(HCl)=2×7.84×10-3 mol×
=0.2 mol,HCl消耗标准液NaOH的物质的量n(NaOH)=0.400 mol/L ×0.0196 L=7.84×10-3 mol,故根据反应方程式中物质转化关系可知反应生成的n(FeCl2)=2n(HCl)=2×7.84×10-3 mol×![]() =0.1568 mol,所以FeCl3的转化率为
=0.1568 mol,所以FeCl3的转化率为![]() ×100%=78.4%。
×100%=78.4%。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案