题目内容
【题目】在含3mol NaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是
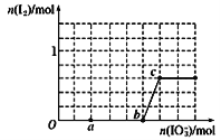
A. a点时NaHSO3过量
B. b点时还原产物为I-
C. b点到c点,KIO3与NaHSO3反应生成I2
D. 加入的KIO3为0.4mol或1.12mol时,I-均为0.4mol
【答案】C
【解析】A项,![]() 在b点才反应完全,a点时过量,故A正确。B,由上述解释可以看出,b点时发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+,
在b点才反应完全,a点时过量,故A正确。B,由上述解释可以看出,b点时发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+,![]() 是氧化剂,其对应的产物
是氧化剂,其对应的产物![]() 为还原产物,故B正确。C,由于
为还原产物,故B正确。C,由于![]() 还原性强于
还原性强于![]() ,所以
,所以![]() 比
比![]() 先与
先与![]() 发生氧化还原反应。b点时加入的
发生氧化还原反应。b点时加入的![]() 物质的量为1mol,和3mol
物质的量为1mol,和3mol![]() 的溶液恰好完全反应,即 2IO3-+6HSO3-=2I-+6SO42-+6H+,b点到c点,
的溶液恰好完全反应,即 2IO3-+6HSO3-=2I-+6SO42-+6H+,b点到c点,![]() 可以结合
可以结合![]() 氧化
氧化![]() 生成
生成![]() ,离子方程式是
,离子方程式是![]() ,在C点时,
,在C点时,![]() 与
与![]() 反应恰好生成
反应恰好生成![]() ,故C错误。D,加入的
,故C错误。D,加入的![]() 为0.4mol,发生反应:2IO3-+6HSO3-=2I-+6SO42-+6H+,生成
为0.4mol,发生反应:2IO3-+6HSO3-=2I-+6SO42-+6H+,生成![]() 为0.4mol,加入的
为0.4mol,加入的![]() 为1.12mol时,先发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+:,3mol
为1.12mol时,先发生反应2IO3-+6HSO3-=2I-+6SO42-+6H+:,3mol![]() 消耗
消耗![]() 1mol,同时生成
1mol,同时生成![]() 1mol,然后发生反应
1mol,然后发生反应![]() ,剩余的0.12mol
,剩余的0.12mol![]() 消耗碘离子0.6mol,所以剩余的
消耗碘离子0.6mol,所以剩余的![]() 也是0.4mol,故D正确。本题正确选项为C。
也是0.4mol,故D正确。本题正确选项为C。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案【题目】某兴趣小组依据Mg与CO2的反应。推测Mg 与SO2在隔绝空气的条件下反应后,剩余固体M可能含有MgO、S、MgS、Mg中的一种或几种。为了验证推测,进行以下实验。请回答有关问题。
实验一:按如图所示进行实验。
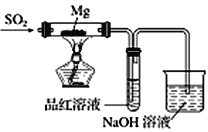
(1)实验室制取二氧化硫的化学方程式为 _________________________________。
(2)上述装置存在不合理之处,请提出一项改进建议 :___________________________。
(3)实验时,先通入SO2直到_______现象出现后,再点燃酒精灯;此操作目的是__________________。
实验二 确定固体M的成分。
实验装置如下图所示。将分液漏斗中稀硫酸(足量)加入到烧瓶中,完全反应后,实验现象如下: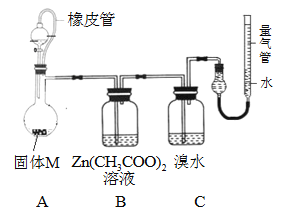
装置 | A | B | C | 量气管 |
现象 | 有残留固体 | 产生白色ZnS沉淀 | 溴水未褪色 | 进入气体v mL(标况) |
(4)实验时,B装置中反应的化学方程式为 __________________________________。
(5)已知镁的相对原子质量为24,则固体M中金属镁的质量为 _________g;实验前装置内有空气,对金属镁质量的测定结果的影响是 ____________(填“偏低”、“偏高”、“无影响”);
(6)依据以上实验,可确定固体M的成分有_________种(填数字)。