题目内容
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法是还原沉淀法。该法的工艺流程为:
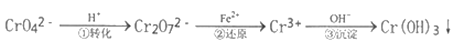
已知:CrO42-(黄色)、Cr2O72- (橙色)
(1)用离子方程式表示第①步可逆反应转化过程___________________。
(2)用离子方程式表示第②步还原反应转化过程___________________。
(3)能说明第①步反应达平衡状态的是_________。
a.Cr2O72-和CrO42-的浓度不变 b.2V(Cr2O72-) =V(CrO42-) c.溶液的颜色不变
(4)第②步中,还原1.5mol Cr2O72-离子,需要_______mol的FeSO47H2O。
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr (OH)3 (s)![]() Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
Cr3+ (aq) +3OH- (aq)。常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-) = 10-32,要使0.01mol/Lc(Cr3+)开始沉淀,溶液的pH应调至__________,若使c(Cr3+)降至10-5mol/L,溶液的pH应调至___________。
【答案】 2 CrO42-(黄色)+2H+![]() Cr2O72- (橙色)+H2O Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ac 9 4 5
Cr2O72- (橙色)+H2O Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ac 9 4 5
【解析】(1)铬酸根与氢离子反应转化为重铬酸根离子,反应的离子方程式为2CrO42-(黄色)+2H+![]() Cr2O72- (橙色)+H2O。(2)Cr元素化合价从+6价降低到+3价,得到3个电子,Fe元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(3)a.Cr2O72-和CrO42-的浓度不变,是平衡标志,a正确;b.2V(Cr2O72-)=V(CrO42-),不能判断正逆反应速率关系,不能判断平衡,b错误;c.溶液的颜色不变,说明浓度不变,反应达到平衡状态,c正确,答案选ac;(4)根据电子得失守恒可知还原1.5mol Cr2O72-离子,需要FeSO47H2O的物质的量是1.5mol×2×3=9.0mol的。(5)根据溶度积常数可知要使0.01mol/Lc(Cr3+)开始沉淀,需要氢氧根的浓度是
Cr2O72- (橙色)+H2O。(2)Cr元素化合价从+6价降低到+3价,得到3个电子,Fe元素化合价从+2价升高到+3价,失去1个电子,根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。(3)a.Cr2O72-和CrO42-的浓度不变,是平衡标志,a正确;b.2V(Cr2O72-)=V(CrO42-),不能判断正逆反应速率关系,不能判断平衡,b错误;c.溶液的颜色不变,说明浓度不变,反应达到平衡状态,c正确,答案选ac;(4)根据电子得失守恒可知还原1.5mol Cr2O72-离子,需要FeSO47H2O的物质的量是1.5mol×2×3=9.0mol的。(5)根据溶度积常数可知要使0.01mol/Lc(Cr3+)开始沉淀,需要氢氧根的浓度是![]() ,则溶液的pH应调至4;若使c(Cr3+)降至10-5mol/L,此时溶液中氢氧根浓度是
,则溶液的pH应调至4;若使c(Cr3+)降至10-5mol/L,此时溶液中氢氧根浓度是![]() ,所以溶液的pH应调至5。
,所以溶液的pH应调至5。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案