题目内容
【题目】以下说法正确的是
A.乙酸的分子式为 C2H4OB.C6H6 一定是苯
C.羟基可表示为—OHD.醛基可表示为—COH
【答案】C
【解析】
A. 乙酸的分子式为 C2H4O2,结构简式为CH3COOH,A错误;
B. 苯分子式为C6H6,但是C6H6不一定是苯,还可以是CH≡C一C≡C一CH2一CH3、CH≡C一CH2一C≡C一CH3、CH≡C一CH2一CH2一C≡CH等,B错误;
C. 羟基表示为—OH,C正确;
D. 醛基一般表示为—CHO,D错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
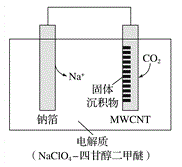
小学生10分钟应用题系列答案【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在潮湿空气中易水解氧化;见光则分解,变成褐色;CuCl难溶于醇和水,可溶于氯离子浓度较大的体系。下图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)
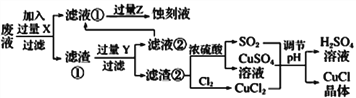
根据以上信息回答下列问题:
(1)写出生产过程中所用物质的名称:____________,________________。
(2)写出产生CuCl的化学方程式:________________________________。
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由________________________________________________。实际生产中SO2要适当过量,原因可能是___(答一点即可).
(4)得到CuC1晶体后,还需要经过水洗、乙醇洗涤两步操作。用乙醇洗涤的作用是________________。
(5)实验探究pH对CuCl产率的影响如下表所示:
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
析出CuCl晶体最佳pH为_________,当pH较大时CuCl产率变低原因是________________。
(6)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.10molL-1硫酸铈标准溶液滴定。已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+。三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 | /tr>
则样品中CuCl的纯度为_______________(结果保留三位有效数字)。
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态