题目内容
6.常温下,向10ml pH=10 的NaOH 溶液中逐滴加入 pH=4的一元酸HA溶液至pH刚好等于7(假设反应前后溶液体积不变即溶液体积能简单相加),则对反应后溶液的叙述正确的是( )| A. | c(A-)>c(Na+) | B. | c(H+)=c(OH-)<c(Na+)<c(A-) | ||
| C. | V(混)≥20mL | D. | V(混)≤20mL |
分析 pH=10的NaOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钠的混合溶液,其体积应小于10mL,以此来解答.
解答 解:pH=10的NaOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA若为强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钠的混合溶液,其体积应小于10mL,即:V(混)≤20mL,故C错误、D正确;
又pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),
溶液中显性离子浓度大于隐性离子浓度,则:c(A-)=c(K+)>c(OH-)=c(H+),故A、B错误
故选D.
点评 本题考查酸碱混合溶液的计算,题目难度中等,明确酸的强弱及电荷守恒是解答本题的关键,注意酸为弱酸时浓度大,其体积应小于碱的体积才能满足混合溶液的pH=7.

练习册系列答案
相关题目
16.鉴别二氧化氮和溴蒸气较为合适的试剂是( )
| A. | 碳酸钠溶液 | B. | 湿润的蓝色石蕊试纸 | ||
| C. | 湿润的淀粉碘化钾试纸 | D. | 硝酸银溶液 |
17.常温下,100mL pH=12的氢氧化钠溶液与100mL pH=2的醋酸溶液相混合后,所得的混合液( )
| A. | 显酸性 | B. | 显碱性 | ||
| C. | 显中性 | D. | 不能确定其酸碱性 |
14.下列有关元素的性质及其规律正确的是( )
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
1.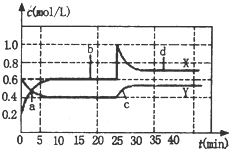 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |
11.下列说法正确的是( )
| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
18.下列说法不正确的是( )
| A. | 煤、石油、天然气都是化石燃料,都是非再生能源,都是一级能源 | |
| B. | 电能、水煤气、氢气都是二级能源,要靠其他能源才能制取 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 凡含有食品添加剂的食物对人体均有害,不可食用 |
15.测定Cu(NO3)2•nH2O的结晶水含量,下列方案中不可行的是( )
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| C. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO | |
| D. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
16.用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 28g乙烯(C2H4)和环丁烷(C4H6)的混合气体中含有的碳原子数为2NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体中含有的原子数为6NA | |
| D. | 常温常压下,22.4L 氯气与足量镁粉充分反应,生成氯化镁1mol |