题目内容
1.用 NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 1molCl2与足量 Fe 反应,转移的电子数为 3NA | |
| B. | 在常温常压下,1.7g NH3含有的原子数为 0.4NA | |
| C. | 标准状况下,11.2 L 水中含有的原子数是 1.5NA | |
| D. | 0.2 mol?L-1 的 Na2SO4溶液中含 Na+数目为 0.4NA |
分析 A、根据反应后氯元素变为-1价来分析;
B、求出氨气的物质的量,然后根据1mol氨气中含4mol原子来分析;
C、标况下水为液态;
D、溶液体积不明确.
解答 解:A、反应后氯元素变为-1价,故1mol氯气反应后转移2mol电子即2NA个,故A错误;
B、1.7g氨气的物质的量为0.1mol,而1mol氨气中含4mol原子,故0.1mol氨气中含0.4mol原子即0.4NA个,故B正确;
C、标况下水为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、溶液体积不明确,故溶液中的钠离子的个数无法计算,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
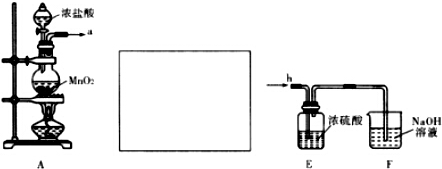
11.无水氯化铝是白色晶体,露置在空气中极易水解,在178℃升华,装有无水氯化铝试剂瓶露置空气中,会产生大量白雾,氯化铝常作为有机合成和石油工业的催化剂.如图是实验室制取氯气并用于制取少量无水氯化铝的装置的仪器和药品.可供选用的试剂如下:
A.饱和食盐水 B.水 C.浓H2SO4 D.碱石灰 E.铝粉 F.二氧化锰 G.浓盐酸 H.烧碱溶液
回答下列问题:(1)写出AlCl3露置在空气中生成白雾的化学方程式:AlCl3+3H2O?Al(OH)3+3HCl.
(2)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(3)填写连接装置中各选用仪器里应盛放的物质:
(4)设计使用(5)仪器和药品有两个主要作用是:防止空气中的水分进入(1)中和吸收剩余氯气防止空气污染.
A.饱和食盐水 B.水 C.浓H2SO4 D.碱石灰 E.铝粉 F.二氧化锰 G.浓盐酸 H.烧碱溶液

回答下列问题:(1)写出AlCl3露置在空气中生成白雾的化学方程式:AlCl3+3H2O?Al(OH)3+3HCl.
(2)从上述仪器中选取若干连成一制备并保存无水AlCl3的装置,用图中各管口标号按先后可连接为:d接e,f接g,h接a,b接c.
(3)填写连接装置中各选用仪器里应盛放的物质:
| 仪器标号 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 试剂标号 | G | F |
12. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
①反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
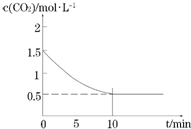
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
9.下列各原子或离子的基态电子排列式错误的是( )
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
6.下列说法正确的是( )
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
13.半导体工业用石英砂做原料通过三个重要反应生产单质硅:
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
①SiO2(s)+2C(s)═Si(s)+2CO(g)△H=+682.44kJ•mol-1,
(石英砂) (粗硅)
②Si(s)+2Cl2(g)═SiCl4(g)△H=-657.01kJ•mol-1
③SiCl4(g)+2Mg(s)═2MgCl2(s)+Si(s)△H=-625.63kJ•mol-1
(纯硅)
用石英砂生产1.00kg纯硅的总放热为( )
| A. | 2.43×104 kJ | B. | 2.35×104 kJ | C. | 2.23×104 kJ | D. | 2.14×104 kJ |
11.下列试剂不小心见到皮肤上,会是皮肤变黄的是( )
| A. | 苏打水 | B. | 浓硝酸 | C. | 氯化铵溶液 | D. | 食盐水 |
 ,试写出:
,试写出: .
. .
. .
. ,
,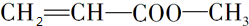 ,
,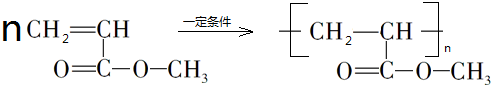 .
.