题目内容
17.工业上消除氮氧化物的污染可用如下反应:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的恒容密闭容器中,测得n(N2)随时间变化的数据如表.下列说法不正确的是( )| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(N2) | 0 | 0.20 | 0.35 | 0.40 | 0.40 |
| T2 | n(N2) | 0 | 0.25 | … | 0.30 | 0.30 |
| A. | T1温度下,CH4的平衡转化率为50% | |
| B. | T1<T2 | |
| C. | a<0 | |
| D. | T2时反应的平衡常数大于T1时反应的平衡常数 |
分析 A.由表中数据可知,40min处于平衡状态,平衡时生成氮气为0.4mol,根据方程式计算消耗甲烷物质的量,进而计算甲烷的转化率;
B.由前10min内,温度T2时生成氮气较多,说明温度T2的反应速率快,温度越高反应速率越快;
C.由B中分析可知,温度T1<T2,T2温度30min处于平衡状态,平衡时氮气的物质的量比T1温度小,说明升高温度平衡逆向移动;
D.升高温度平衡逆向移动,平衡常数减小.
解答 解:A.由表中数据可知,40min处于平衡状态,平衡时生成氮气为0.4mol,根据方程式可知消耗甲烷物质的量为0.4mol,则甲烷的转化率为$\frac{0.4mol}{0.5mol}$×100%=80%,故A错误;
B.由前10min内,温度T2时生成氮气较多,说明温度T2的反应速率快,温度越高反应速率越快,故温度T1<T2,故B正确;
C.由B中分析可知,温度T1<T2,T2温度30min处于平衡状态,平衡时氮气的物质的量比T1温度小,说明升高温度平衡逆向移动,则正反应为放热反应,故a<0,故C正确;
D.升高温度平衡逆向移动,平衡常数减小,T2时反应的平衡常数小于T1时反应的平衡常数,故D错误,
故选:AD.
点评 本题考查化学平衡计算及影响因素、平衡常数影响因素等,关键是根据数据判断温度大小,较好的考查学生对数据的分析处理能力,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.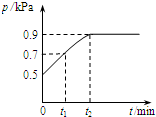 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.1mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | t1时n(X)=0.04 mol | |
| B. | t1到t2,混合气体的平均相对分子量增大 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率减少 |
12. (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
①反应 CO2(g)+H2(g)?CO(g)+H2O(g)△H,平衡常数K,则△H=△H1-△H2(用△H1和△H2表示),K=$\frac{{K}_{1}}{{K}_{2}}$(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)?CO(g)+H2O(g)是吸热反应(填“吸热”或“放热”).
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
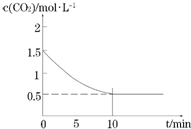
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
 (1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1
(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H1,平衡常数为K1反应Fe(s)+H2O(g)?FeO(s)+H2(g)△H2,平衡常数为K2
在不同温度时K1、K2的值如表:
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
②能判断恒温恒容容器CO2(g)+H2(g)?CO(g)+H2O(g)达到化学平衡状态的依据是B(填序号).
A.容器中压强不变 B.混合气体中c(CO)不变 C.容器中密度不变 D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g)?FeO(s)+CO(g),CO2的浓度与时间的关系如图所示:
①该条件下反应的平衡常数为2;0-10min的平均反应速率v(CO)=0.1mol•L-1•min-1;
若铁粉足量,CO2的起始浓度为2.0mol•L-1,则平衡时CO2的浓度为0.67mol•L-1.
②下列措施中能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号)
A.升高温度 B.增大压强 C.充入一定量的CO2D.再加入一定量铁粉.
9.下列各原子或离子的基态电子排列式错误的是( )
| A. | N3-:1s22s22p3 | B. | F-:1s22s22p6 | ||
| C. | Fe2+:1s22s22p63s23p63d6 | D. | O2-:1s22s22p6 |
6.下列说法正确的是( )
| A. | 因为SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因为高温时发生反应:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸强 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
7.3mol乙炔跟5mol氢气在密闭容器中反应,当其达到平衡时,生成amol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
| A. | 6mol | B. | 10mol | C. | 3amol | D. | 3mol |

 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气,NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: