题目内容
(14分)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 。
(2)上述反应中产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为 L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 。
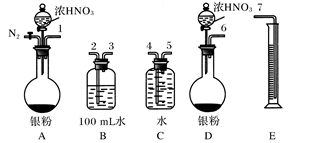
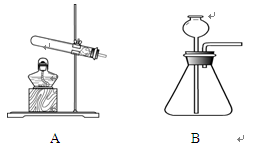
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:
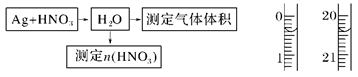
①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 。
②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,则氧化剂与氧化产物的物质的量之比为 。
(2)上述反应中产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3— = 2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成48g S,则生成标准状况下的NO2的体积为 L。若准确测得的实际体积小于理论值(计算值),请分析可能原因 。
(4)某课外活动小组设计了以下实验方案验证Ag与浓HNO3反应的过程中可能产生NO。其实验流程图如下:

①测定硝酸的物质的量:
反应结束后,从如图B装置中所得100 mL溶液中取出25.00 mL溶液,用0.1 mol·L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 。

②测定NO的体积:
若实验测得NO的体积为112.0 mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
(1)1:1 (2)氢氧化钠(或硫酸铜)溶液
(3)112L 部分NO2转化为N2O4使体积减小(或其它合理答案)
(4)①0.008 mol ②有 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
(3)112L 部分NO2转化为N2O4使体积减小(或其它合理答案)
(4)①0.008 mol ②有 因为NO2与水反应生成的NO的体积小于收集到的NO的体积(89.6<112.0)
(1)As由+3降为+2,Sn由+2升为+4,根据得失电子总数相等,As2S3和SnCl2的物质的量之比为1:1。
(2)反应中氧化剂是As2S3,生成的H2S气体可用NaOH溶液(或其它碱溶液)或硫酸铜溶液吸收。
(3)由反应式可知3×32gS对应标准状况下10×22.4LNO2,若生成48g S,则生成标准状况下的NO2的体积为112L;
由于存在可逆反应2NO2 N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值
N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值
(4)实验装置图为:

①消耗的NaOH溶液的体积为20.40—0.40=20.00ml,则硝酸的浓度为:c(HNO3)×25=0.1×20,c(HNO3)=0.08mol/L;
则在B容器中生成硝酸的物质的量为0.08×0.1=0.008mol
②由反应3NO2+H2O=2HNO3+NO可知,当生成0.008molHNO3时,生成的NO的体积为 =89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
=89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
(2)反应中氧化剂是As2S3,生成的H2S气体可用NaOH溶液(或其它碱溶液)或硫酸铜溶液吸收。
(3)由反应式可知3×32gS对应标准状况下10×22.4LNO2,若生成48g S,则生成标准状况下的NO2的体积为112L;
由于存在可逆反应2NO2
 N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值
N2O4,部分NO2转化为N2O4,致使测得的实际体积小于理论值(4)实验装置图为:

①消耗的NaOH溶液的体积为20.40—0.40=20.00ml,则硝酸的浓度为:c(HNO3)×25=0.1×20,c(HNO3)=0.08mol/L;
则在B容器中生成硝酸的物质的量为0.08×0.1=0.008mol
②由反应3NO2+H2O=2HNO3+NO可知,当生成0.008molHNO3时,生成的NO的体积为
 =89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
=89.6ml,但小于实验测得NO的体积为112.0 mL,故一定有NO生成
练习册系列答案
相关题目
 3HF △H>0, H2F2
3HF △H>0, H2F2
 璃窗,中间带有一根玻璃短柄。用此仪器进行有关实验时,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是
璃窗,中间带有一根玻璃短柄。用此仪器进行有关实验时,具有装置简单、操作方便、现象明显、可反复使用等优点。用此仪器不能反复进行的实验是