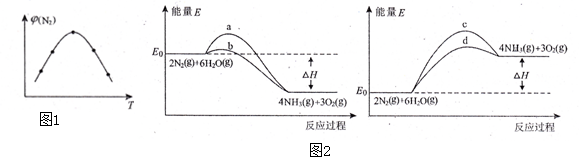
题目内容
10.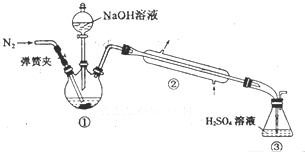 某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.
某小组以废铁屑、稀硫酸、饱和(NH4)2SO4溶液为原料,经过一系列反应和操作后,合成了浅蓝绿色晶体X.为确定其组成,进行如下实验.I.结晶水的测定:称取7.84g浅蓝绿晶体,加热至100℃失去结晶水,冷却至室温
后,称重,质量为5.68g.
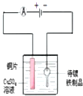
Ⅱ.NH4+的测定:将上述5.68g固体置于如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入氮气,用40.00mL l mol•L-1的硫酸溶液吸收产生氨气.蒸氨结束后取下接收瓶,用2mol•L-1NaOH标准溶液滴定过剩的硫酸,到终点时消耗20.00mLNaOH溶液.
Ⅲ.铁元素的测定:将上述实验结束后三颈瓶中的溶液全部倒入锥形瓶中,向其中加入适量3%H2O2的溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后;测得其质量为1.6g. 回答下列问题:
(1)在实验I中,不可能用到的实验仪器是AD(填正确答案标号).
A.烧杯 B.铁架台(带铁圈) C.坩埚 D.蒸发皿
E.酒精灯 F.干燥器 G.托盘天平
(2)在实验Ⅱ中,通入氮气的目的是将溶液中的氨全部蒸出.蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是用蒸馏水冲洗冷凝管装置2-3次,洗涤液并入锥形瓶中.
(3)在实验Ⅱ中,用NaOH标准溶液滴定过剩的硫酸时,应使用碱式滴定管;可使用的指示剂为酚酞(或甲基红).
(4)在实验中,检验沉淀是否洗净的方法是取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净.
(5)根据上述实验数据计算,该浅蓝绿晶体的化学式为FeSO4•(NH4)2SO4•6H2O或(NH4)2Fe(SO4)2•6H2O.三颈瓶中发生反应的离子方程式为2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O.
分析 (1)根据实验步骤中的各步操作,确定所需的实验仪器;
(2)实验Ⅱ的目的是测定铵根离子的含量,铵根离子含量根据氨气的量测定,将氨气全部赶出需通入氮气,蒸氨结束后用蒸馏水冲洗冷凝管装置2-3次,洗涤液并入锥形瓶中,保证生成的氨气全部进入锥形瓶中与硫酸反应;
(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中;NaOH溶液和H2SO4溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂;
(4)溶液中存在硫酸铵,可用硝酸酸化的硝酸钡溶液检验最后一次洗涤液中是否存在硫酸根离子,以判断沉淀是否洗净;
(5)7.84g浅蓝绿晶体,加热后,称重,质量为5.68g,根据质量差求出水的质量及其物质的量,根据反应式2NaOH+H2SO4=Na2SO4+2H2O求出剩余硫酸的物质的量,根据反应式2NH3+H2SO4=(NH4)2SO4求出与氨气反应的硫酸的物质的量,据此求出与硫酸反应的氨气的物质的量,2Fe2++H2O2+2H+=2Fe3++2H2O,测得其质量为1.6g为氧化铁,根据以上所求数据得出n(NH4+):n(Fe2+):n((SO42-):n(H2O)=2:1:2:6,据此求出该浅蓝绿晶体的化学式,亚铁离子和铵根离子和氢氧根反应生成氢氧化亚铁,据此书写离子反应方程式.
解答 解:(1)结晶水的测定:称量需要托盘天平(G),加热需要酒精灯(E)、坩埚(C)、铁架台带铁圈(B)、玻璃棒、干燥时需干燥器(F)等,无须用烧杯(A)、蒸发皿(D),
故答案为:AD;
(2)实验Ⅱ的目的是测定铵根离子的含量,通过铵根离子和碱反应生成的氨气的量测定,NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,根据将氨气全部赶出,减小误差需通入氮气,蒸氨结束后用蒸馏水冲洗冷凝管装置2-3次,洗涤液并入锥形瓶中,目的保证生成的氨气全部进入锥形瓶中与硫酸反应,
故答案为:将溶液中的氨全部蒸出;用蒸馏水冲洗冷凝管装置2-3次,洗,涤液并入锥形瓶中;
(3)碱只能盛放在碱式滴定管中,酸性溶液只能盛放在酸式滴定管中,所以用NaOH标准溶液确定过剩的H2SO4时,应使用碱式滴定管盛放NaOH溶液;NaOH溶液和硫酸溶液恰好反应后呈中性,可以选择酸性或碱性变色范围内的指示剂,甲基红为酸性变色指示剂、酚酞为碱性变色指示剂,所以可以选取甲基红或酚酞作指示剂,
故答案为:碱;酚酞(或甲基红);
(4)溶液中存在硫酸铵,若未洗净,加入1-2滴稀硝酸,再滴入硝酸钡溶液,有白色沉淀生成,所以检验沉淀是否洗净的方法是:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净,
故答案为:取最后一次洗涤液于试管中,滴入1-2滴稀硝酸,再滴入硝酸钡溶液,若无白色沉淀生成,则说明沉淀已经洗净;
(5)由题给数据可知7.84g摩尔盐中m(H2O)=7.84g-5.68g=2.16g,n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol,
消耗氢氧化钠的物质的量是n=cv=lmol•L-1×40.00mL=0.04mol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知:剩余硫酸的物质的量是2mol•L-1×20.00mL×$\frac{1}{2}$=0.02mol,则根据反应式2NH3+H2SO4=(NH4)2SO4可知:与氨气反应的硫酸的物质的量是0.04mol-0.02mol=0.02mol,则与硫酸反应的氨气的物质的量是0.02mol×2=0.04mol,生成的m(NH3)=0.68g,2Fe2++H2O2+2H+=2Fe3++2H2O,测得其质量为1.6g为氧化铁,m(Fe2O3)=1.6g,n(Fe2O3)=$\frac{1.6g}{160g/mol}$=0.01mol,则m(NH4+)=0.04mol×18g/mol=0.72g,m(Fe2+)=0.02mol×56g/mol=1.12g,则m(SO42-)=7.84g-2.16g-0.72g-1.12g=3.84g,n(SO42-)=$\frac{3.84g}{96g/mol}$=0.04mol,所以n(NH4+):n(Fe2+):n((SO42-):n(H2O)=0.04mol:0.02mol:0.04mol:0.12mol=2:1:2:6,该浅蓝绿晶体的化学式为FeSO4•(NH4)2 SO4•6H2O 或(NH4)2Fe(SO4)2•6H2O,三颈瓶中亚铁离子和铵根离子和氢氧根反应生成氢氧化亚铁,反应为:2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O,
故答案为:FeSO4•(NH4)2 SO4•6H2O 或(NH4)2Fe(SO4)2•6H2O;2NH4++Fe2++4OH-=Fe(OH)2↓+2NH3↑+2H2O.
点评 本题主要考查了晶体组成的测定,同时考查了实验知识,主要是实验过程分析判断,质量分数的测定,熟练基本实验操作和掌握物质组成的测定方法,弄清实验原理是解题的关键,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | $\frac{a+b+c}{V}$molgL-1 | B. | $\frac{a+b+2c}{V}$molgL-1 | C. | $\frac{2a+b+c}{V}$molgL-1 | D. | $\frac{b+2c}{V}$molgL-1 |
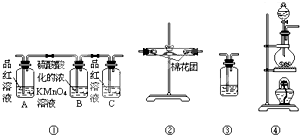 已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊.如图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O.