题目内容
A、B、C、D、E、F是原子序数依次增大短周期元素.A、D同族,B、C同周期;B原子最外层电子数是次外层的两倍;在周期表中A的原子半径最小;C是地壳中含量最多的元素,C是F不同周期的邻族元素;E和F的原子序数之和为30.由于上述六种元素中的两种或三种组成的甲、乙、丙、丁、戊、己六种化合物如下表所示:
请完成下列问题:
(1)乙的电子式: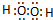
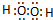 ;向含有1mol 乙的水溶液中加入MnO2,该反应中电子转移的物质的量为
;向含有1mol 乙的水溶液中加入MnO2,该反应中电子转移的物质的量为
(2)D的离子结构示意图
 ,己的空间构型
,己的空间构型
(3)8g 丙完全燃烧,生成液态水和CO2,放出445kJ的热量,则丙燃烧的热化学方程式为
(4)F的单质与甲反应的离子方程式为
(5)将丁与戊两种水溶液混合,发生反应的离子方程式为
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | n(A):n(C)=2:1 | n(A):n(C)=1:1 | n(B):n(A)=1:4 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | n(D):n(B):n(C)=2:1:3 | n(E):n(F)=1:3 | n(B):n(F)=1:4 |
(1)乙的电子式:
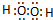
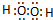
1
1
mol.(2)D的离子结构示意图


正四面体
正四面体
.(3)8g 丙完全燃烧,生成液态水和CO2,放出445kJ的热量,则丙燃烧的热化学方程式为
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol
.(4)F的单质与甲反应的离子方程式为
Cl2+H2O=H++Cl-+HClO
Cl2+H2O=H++Cl-+HClO
.(5)将丁与戊两种水溶液混合,发生反应的离子方程式为
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑
.分析:A、B、C、D、E、F是原子序数依次增大短周期元素,B、C同周期,B原子最外层电子数是次外层的两倍,最外层电子数不超过8个,所以B是C元素;在周期表中A的原子半径最小,则A是H元素,A、D同族,且D的原子序数大于B,所以D是Na元素;C是地壳中含量最多的元素,则C是O元素,C是F不同周期的邻族元素,则F属于第VA族或第VIIA族;E和F的原子序数之和为30,E的原子序数大于11,F的原子序数大于15,所以F是Cl元素,则E是Al元素,所以A、B、C、D、E、F分别是H、C、O、Na、Al、Cl元素,
甲中n(A):n(C)=2:1,则甲为H2O;
乙中n(A):n(C)=1:1,则乙为H2O2;
丙中n(B):n(A)=1:4,则丙为CH4;
丁中n(D):n(B):n(C)=2:1:3,则丁为Na2CO3;
戊中n(E):n(F)=1:3,则戊为AlCl3;
己中n(B):n(F)=1:4,则己为CCl4;
结合物质的结构和性质分析解答.
甲中n(A):n(C)=2:1,则甲为H2O;
乙中n(A):n(C)=1:1,则乙为H2O2;
丙中n(B):n(A)=1:4,则丙为CH4;
丁中n(D):n(B):n(C)=2:1:3,则丁为Na2CO3;
戊中n(E):n(F)=1:3,则戊为AlCl3;
己中n(B):n(F)=1:4,则己为CCl4;
结合物质的结构和性质分析解答.
解答:解:A、B、C、D、E、F是原子序数依次增大短周期元素,B、C同周期,B原子最外层电子数是次外层的两倍,最外层电子数不超过8个,所以B是C元素;在周期表中A的原子半径最小,则A是H元素,A、D同族,且D的原子序数大于B,所以D是Na元素;C是地壳中含量最多的元素,则C是O元素,C是F不同周期的邻族元素,则F属于第VA族或第VIIA族;E和F的原子序数之和为30,E的原子序数大于11,F的原子序数大于15,所以F是Cl元素,则E是Al元素,所以A、B、C、D、E、F分别是H、C、O、Na、Al、Cl元素,
甲中n(A):n(C)=2:1,则甲为H2O;
乙中n(A):n(C)=1:1,则乙为H2O2;
丙中n(B):n(A)=1:4,则丙为CH4;
丁中n(D):n(B):n(C)=2:1:3,则丁为Na2CO3;
戊中n(E):n(F)=1:3,则戊为AlCl3;
己中n(B):n(F)=1:4,则己为CCl4;
(1)乙为H2O2,其电子式为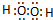 ,1mol双氧水分解转移电子的物质的量=1mol×(1-0)=1mol,
,1mol双氧水分解转移电子的物质的量=1mol×(1-0)=1mol,
故答案为: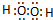 ,1;
,1;
(2)D为Na元素,钠离子核外有10电子,其离子结构示意图为 ,己为CCl4,四氯化碳分子中碳原子含有4个共价单键,且不含孤电子对,呈正四面体型结构,
,己为CCl4,四氯化碳分子中碳原子含有4个共价单键,且不含孤电子对,呈正四面体型结构,
故答案为: ;正四面体;
;正四面体;
(3)丙是甲烷,8g 丙的物质的量是0.5mol,8g丙完全燃烧,生成液态水和CO2,放出445kJ的热量,则1mol甲烷完全燃烧放出890kJ能量,所以其热化学反应方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol;
(4)氯气和水反应生成盐酸和次氯酸,离子反应方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(5)丁为Na2CO3,戊为AlCl3,碳酸钠和氯化铝能发生双水解反应,离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
甲中n(A):n(C)=2:1,则甲为H2O;
乙中n(A):n(C)=1:1,则乙为H2O2;
丙中n(B):n(A)=1:4,则丙为CH4;
丁中n(D):n(B):n(C)=2:1:3,则丁为Na2CO3;
戊中n(E):n(F)=1:3,则戊为AlCl3;
己中n(B):n(F)=1:4,则己为CCl4;
(1)乙为H2O2,其电子式为
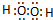 ,1mol双氧水分解转移电子的物质的量=1mol×(1-0)=1mol,
,1mol双氧水分解转移电子的物质的量=1mol×(1-0)=1mol,故答案为:
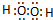 ,1;
,1;(2)D为Na元素,钠离子核外有10电子,其离子结构示意图为
 ,己为CCl4,四氯化碳分子中碳原子含有4个共价单键,且不含孤电子对,呈正四面体型结构,
,己为CCl4,四氯化碳分子中碳原子含有4个共价单键,且不含孤电子对,呈正四面体型结构,故答案为:
 ;正四面体;
;正四面体;(3)丙是甲烷,8g 丙的物质的量是0.5mol,8g丙完全燃烧,生成液态水和CO2,放出445kJ的热量,则1mol甲烷完全燃烧放出890kJ能量,所以其热化学反应方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ/mol;
(4)氯气和水反应生成盐酸和次氯酸,离子反应方程式为Cl2+H2O=H++Cl-+HClO,
故答案为:Cl2+H2O=H++Cl-+HClO;
(5)丁为Na2CO3,戊为AlCl3,碳酸钠和氯化铝能发生双水解反应,离子方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑.
点评:本题以元素推断为载体,考查离子结构示意图、电子式、热化学方程式书写等内容,正确推断元素及物质是解本题关键,难度中等.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.