题目内容
11.二氧化氯(ClO2)为一种黄绿色气体,是一种高效、广谱、安全的杀菌、消毒剂.制备ClO2的方法有多种.
(1)纤维素还原法制ClO2.其原理是:纤维素水解得到的最终产物A与NaClO3反应生成ClO2.完成反应的化学方程式:其流程如下:
□1C6H12O6+□NaClO3+□H2SO4═□ClO2↑+□CO2↑+□H2O+□12Na2SO4
(2)电解食盐水制取ClO2,其流程如图1:
①粗盐中含有Ca2+、Mg2+、SO42-等杂质.除杂操作时,往粗盐水中加入试剂的顺序依次为BaCl2、NaOH和Na2CO3或NaOH、BaCl2和Na2CO3(填化学式),充分反应后将沉淀一并滤去,再加入盐酸.
②食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸在发生器中反应生成ClO2,写出发生器中生成ClO2的化学方程式2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O.
③上述流程中,可循环利用的物质有NaCl、Cl2;按照绿色化学原则,电解槽阴极产生的气体与方框中物质的物质的量之比为6:5时,原子的利用率为100%.
(3)实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如图2:
已知:(I)A气体在标准状况下的密度为0.089g/L;
(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝.
①电解时,发生反应的化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3.
②NCl3与NaClO2(亚氯酸钠)按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-.
分析 (1)纤维素水解得到的最终产物A为葡萄糖,NaClO3生成ClO2,氯元素从+5价降到+4价,葡萄糖中碳从0价升到+4价,根据元素守恒和电荷守恒配平方程式;
(2)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,用钡离子除去硫酸根离子,用氢氧根除去镁离子,用碳酸根除去钙离子,同时注意除杂是示能引入新的杂质,据此判断加入试剂的顺序;
②根据氧化还原反应化合价升降规律,NaClO3与盐酸反应生成ClO2的同时会生成氯气,据此写出化学方程式;
③根据图1流程可知,电解氯化钠溶液生成NaClO3的同时有氢气产生,被充适量的氯气后,氢气和氯气合成氯化氢,氯化氢再与NaClO3反应得ClO2,所以氯化钠和氯气都是流程中的原料,据此判断可循环利用的物质,电解槽阴极产生的气体应为氢气,方框中物质应为氯气,根据元素守恒可确定它们的物质的量之比;
(3)A气体在标准状况下的密度为0.089g/L,则A气体为氢气,(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝,则B为氨气,
①根据流程可知,电解时反应物为氯化铵和盐酸,生成物为氢气和NCl3,据此书写化学方程式;
②NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,根据电荷守恒和元素守恒书写离子方程式;
解答 解:(1)纤维素水解得到的最终产物A为葡萄糖,NaClO3生成ClO2,氯元素从+5价降到+4价,葡萄糖中碳从0价升到+4价,反应的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
故答案为:1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4;
(2)①粗盐中含有Ca2+、Mg2+、SO42-等杂质,用钡离子除去硫酸根离子,用氢氧根除去镁离子,用碳酸根除去钙离子,同时注意除杂是示能引入新的杂质,碳酸根离子要放在最后加入,所以加入试剂的顺序为BaCl2、NaOH和Na2CO3或NaOH、BaCl2和Na2CO3,
故答案为:BaCl2、NaOH和Na2CO3或NaOH、BaCl2和Na2CO3;
②根据氧化还原反应化合价升降规律,NaClO3与盐酸反应生成ClO2的同时会生成氯气,反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O;
③根据图1流程可知,电解氯化钠溶液生成NaClO3的同时有氢气产生,被充适量的氯气后,氢气和氯气合成氯化氢,氯化氢再与NaClO3反应得ClO2,所以氯化钠和氯气都是流程中的原料,结合电解槽和ClO2发生器中产物可知,可循环利用的物质是NaCl、Cl2,电解槽阴极产生的气体应为氢气,方框中物质应为氯气,根据根据反应NaCl+3H2O$\frac{\underline{\;电解\;}}{\;}$NaClO3+3H2及反应2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,可知反应中产生的H2、Cl2的物质的量之比为6:1,而反应中H2、Cl2的物质的量之比为1:1,要使原子的利用率为100%,则产生的H2和要补充的氯气的物质的量之比为6:5,
故答案为:NaCl、Cl2;6:5;
(3)A气体在标准状况下的密度为0.089g/L,则A气体为氢气,(Ⅱ)气体B能使湿润的红色石蕊试纸变蓝,则B为氨气,
①根据流程可知,电解时反应物为氯化铵和盐酸,生成物为氢气和NCl3,所以化学方程式为NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3,
故答案为:NH4Cl+2HCl$\frac{\underline{\;电解\;}}{\;}$3H2↑+NCl3;
②NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2,根据电荷守恒和元素守恒可知其离子方程式为NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
故答案为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-.
点评 本题考查氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 是否具有丁达尔效应是胶体与溶液、浊液的根本区别 | |
| C. | 纯净盐酸为纯净物、冰水混合物为混合物 | |
| D. | 烧碱、纯碱都属于碱,油脂、甘油都属于酯 |
| A. | 称取10.6gNaCO3,加入100mL容量瓶中,加水溶解,定容 | |
| B. | 称取10.6gNaCO3,加入100mL蒸馏水,搅拌,溶解 | |
| C. | 移液时未用玻璃棒引流,直接倒入容量瓶中 | |
| D. | 定容后,反复倒转,摇匀 |
(1)碱性;Sr(OH)2<Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的 观点解释其原因是同一主族元素,原子最外层电子数相同.
(2)碳酸锶是最重要的锶化合物.用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3.
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀的pH | 1.9 | 7.0 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.0 | 4.7 |
②步骤Ⅱ中,能与盐酸反应而溶解的物质有SrCO3、BaCO3、FeO、Fe2O3、Al2O3.
③步骤Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全.
④下列关于该工艺流程的说法正确的是ac(填字母代号).
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率.
| A. | HR | B. | H2R | C. | RH4 | D. | RH3 |
| A. | CH3CH=C(CH3) CH3 3-甲基-2-丁烯 | |
| B. | CH3CH(CH3)CH(Cl)CH3 3-甲基-2-氯丁烷 | |
| C. | CH3CH(OH)CH2CH3 2-羟基丁醇 | |
| D. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 |
 +2C2H5OH
+2C2H5OH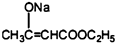 +CH3COOH→
+CH3COOH→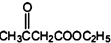 +CH3COONa
+CH3COONa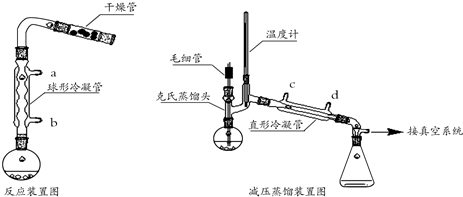
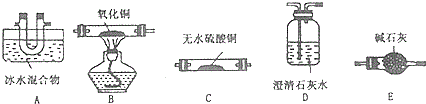
 某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.
某同学以甘蔗渣为原料用水解一氧化一水解循环进行制取草酸并探究测定草酸晶体(H2C2O4•xH2O)的某些性质.通过查阅资料可知:草酸易溶于水,是一种重要的化工原料,广泛用于药物生产、高分子合成等工业,草酸晶体受热到100℃时失去结晶水,成为无水草酸.157℃时大量升华,并开始分解;草酸蒸气在低温下可冷凝为固体;草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊.