题目内容
6.3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂.其相对分子质量为130,常温下为无色液体,沸点181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备.乙酸乙酯相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃.反应原理:2CH3COOC2H5+C2H5ONa→
 +2C2H5OH
+2C2H5OH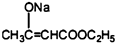 +CH3COOH→
+CH3COOH→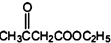 +CH3COONa
+CH3COONa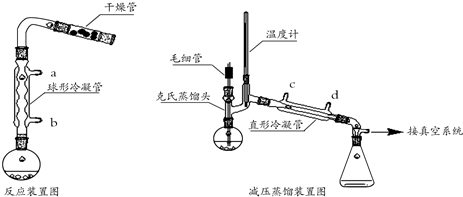
【实验步骤】
(1)加热反应:向反应装置中加入32mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1,.6g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失.
(2)产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32mL 30%醋酸水溶液,使反应液分层.用分液漏斗分离出酯层.酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清.
(3)蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃.然后改用减压蒸馏,得到产品2.0g.
回答下列问题:
①从反应原理看,无水乙醇的作用是催化剂.
②反应装置中加干燥管是为了防湿气进入反应体系中以保证反应体系干燥.两个装置中冷凝管的作用不相同(填“相同”或“不相同”),冷却水进水口分别为b和d(填图中的字母).
③产物后处理中,滴加稀醋酸的目的是中和生成的钠盐,使之变成产物,稀醋酸不能加多了,原因是酸多了会增加产物在水中的溶解度.用分液漏斗分离出酯层的操作叫分液.碳酸钠溶液洗涤的目的是中和醋酸.加碳酸钾的目的是干燥.
④采用减压蒸馏的原因是3-丁酮酸乙酯沸点高,在沸点温度下还易分解.
⑤本实验所得到的3-丁酮酸乙酯产率是B(填正确答案标号).
A.10% B.22% C.19% D.40%
分析 ①催化剂参加反应,但反应前后质量和化学性质不变,根据反应原理,无水乙醇参与反应,但反应前后都有,为催化剂;
②空气中含有水蒸气,因此装置中加干燥管是为了防湿气进入反应体系中以保证反应体系干燥;
反应装置中冷凝管的作用是冷凝回流,挺高原料的利用率,减压装置中冷凝管的作用是冷却蒸发出的蒸汽便于得到产品;
为充分冷凝,使冷水充满冷凝器,因此冷却水采取逆流原理;
③由于产物中含有钠盐,因此产物处理后,滴加稀醋酸的目的是中和生成的钠盐,使之变成产物;分离互不相溶液体操作为分液;
酯类在碳酸钠溶液中的溶解度小,滴加碳酸钠溶液可以除去混有的乙酸;碳酸钾吸水,因此加碳酸钾的目的是干燥产品;
④3-丁酮酸乙酯沸点高,而受热温度超过95℃摄氏度时就会分解,所以需要减压蒸馏;
⑤根据反应物的用量可知钠不足,因此理论上生成产品的物质的量是0.07mol,根据m=nM计算理论上3-丁酮酸乙酯质量,进而计算其产率.
解答 解:①在反应原理中可以得到乙醇钠发生了反应生成了乙醇,在反应装置中加入的是乙醇,乙醇可以与金属钠反应生成乙醇钠,当乙醇钠反应后又生成了乙醇,故乙醇的作用是催化剂,
故答案为:催化剂;
②空气中含有水蒸气,因此装置中加干燥管是为了防止空气中的水蒸汽进入反应体系中以保证反应体系干燥;反应装置中冷凝管的作用是冷凝回流,提高原料的利用率,减压装置中冷凝管的作用是冷却蒸发出的蒸汽便于得到产品,为充分冷凝,故两个冷凝管的作用不同;左侧装置中冷凝水从b口进入,右侧冷凝管中的冷凝水应从d口进入,
故答案为:防湿气进入反应体系中以保证反应体系干燥;不相同;b、d;
③在第一步骤中生成的是产物的钠盐,加入稀醋酸使其变成产物;因产物易溶于水,当在其中加入的酸过多后会增加产物在水中的溶解度,醋酸不能滴加的过多;用分液漏斗分离出酯层的操作叫分液;碳酸钠溶液可以与加入的过量的醋酸反应,故洗涤的目的是中和醋酸;碳酸钾可以做干燥剂,对产物进行干燥,
故答案为:中和生成的钠盐,使之变成产物;酸多了会增加产物在水中的溶解度;分液;中和醋酸;干燥;
④因3-丁酮酸乙酯沸点181℃,在温度超过95℃摄氏度时就会分解,所以在进行蒸馏时的温度不能过高,需要减压蒸馏,
故答案为:3-丁酮酸乙酯沸点高,在沸点温度下还易分解;
⑤反应物中有0.32mol乙酸乙酯、0.07mol金属钠,乙酸乙酯过量,钠不足,因此理论上生成产品的物质的量是0.07mol,质量为0.07mol×130g/mol=9.1g,产率=$\frac{2.0g}{9.1g}$×100%=22%,
故选B.
点评 本题考查了物质制备方案的设计、对装置与操作的分析评价、物质的分离提纯、产率的计算,试题充分考查了学生的分析能力、理解能力及化学实验能力,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 在电子云示意图中,小黑点密集表示电子在核外空间单位体积内电子出现的机会多 | |
| C. | 强电解质溶液一定比弱电解质溶液的导电能力强 | |
| D. | 常用原子光谱进行有机物相对分子质量的测定 |
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
| A. | 常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好 | |
| B. | 常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好 | |
| C. | 向含有Mg2+,Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021 | |
| D. | 无法利用Ca(OH)2制备NaOH |
| A. | 高温结构陶瓷是新型无机非金属材料 | |
| B. | 钢是用量最大、用途最广的合金,分为碳素钢和合金钢 | |
| C. | 硅芯片是各种计算机、微电子产品的核心材料 | |
| D. | 单晶硅常用于制造光导纤维 |
(1)准确称量4.1g含有少量中性易溶杂质的样品,配成250mL待测溶液.称量时样品可放在A(填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,不可选用B(填编号字母)作指示剂.
(A)甲基橙 (B)石蕊 (C)酚酞
(3)用0.2010mol•L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视锥形瓶内溶液颜色变化和滴液的流速,直到滴定终点.
(4)根据你所选择的指示剂,正确判断滴定终点的现象是:滴入最后一滴NaOH溶液时,溶液刚好由无色变为粉红(或由黄色变为橙色),且半分钟内不变色.
(5)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4020mol•L-1,烧碱样品的纯度是98.05%
| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 0.20 | 20.80 |
| 第三次 | 10.00 | 4.10 | 24.00 |
①观察酸式滴定管液面时,开始仰视,滴定终点平视,则滴定结果偏低.
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果偏高.
(1)自然界中各种原生铜的硫化物经氧化、淋滤作用后转化为硫酸铜溶液,并向溶部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),慢慢地转变为铜蓝(CuS).
①硫化铜与氧气在淋滤作用下生成硫酸铜,该过程的化学方程式为CuS+2O2 $\frac{\underline{\;一定条件\;}}{\;}$CuSO4.
②渗透到地下深层的硫酸铜溶液遇到闪锌矿发生反应的离子方程式为Cu2+(aq)+ZnS(s)=CuS(s)+Zn2+(aq);请简要说明该反应能发生的原因:在一定条件下,溶解度小的矿物可以转化为溶解度更小的矿物.
(2)工业上利用辉铜矿(主要成分是Cu2S)冶炼铜,为了测定辉铜矿样品的纯度,可将样品与过量的酸性高锰酸钾溶液反应,该反应的离子方程式为Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O.
(3)工业上可用多种方法制备硫酸晶体.如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程图.
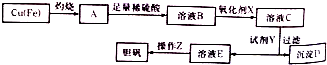
已知:
| 溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
| 完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
①溶液B中含有的阳离子有Fe2+、Fe3+、H +、Cu2(填离子符号),氧化剂X宜选用的物质是H2O2(填化学式);
②加入试剂Y是为了调节pH,试剂Y可以选择的是CuO或CuCO3或Cu(OH)2;
③操作Z的步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥等.
④将废铜屑投入到废酸(含硝酸、硫酸)中可以制备硫酸铜晶体,若某100mL废酸混合液中,c(HNO3)=2mol•L-1、c(H2SO4)=4mol•L-1(不含其他酸或氧化剂),则该废酸理论上最多能制备硫酸铜晶体(CuSO4•5H2O)的质量为75g.
⑤现有一块含有铜绿的铜片(假设不含其他杂质)在空气中灼烧可生成氧化铜等物质,经测定,反应前后固体的质量相同,则该铜片中铜的生锈率为34%[已知:金属生锈率=(已生锈的金属质量/金属的总质量)×100%].
| A. | 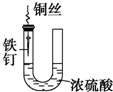 铁钉易被腐蚀 | |
| B. | 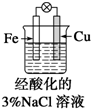 滴加少量KSCN溶液,溶液变为血红色 | |
| C. |  燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀 | |
| D. |  用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
| 选项 | 实验目的 | 主要玻璃仪器 | 试剂 |
| A | 鉴别Na2CO3和NaHCO3溶液 | 试管、胶头滴管 | 澄清石灰水 |
| B | 分离I2和CCl4的混合物 | 分液漏斗、烧杯 | 乙醇 |
| C | 实验室制取干燥的NH3 | 试管、酒精灯、带导管的橡皮塞 | NH4Cl、Ca(OH)2、碱石灰 |
| D | 测定NaOH溶液的浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、酚酞试剂、0.1000mol•L-1盐酸 |
| A. | A | B. | B | C. | C | D. | D |
