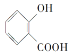
题目内容
【题目】下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO32-=HCO3-
B.草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C.往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
【答案】C
【解析】
A. 往稀盐酸中逐滴加入Na2CO3溶液,开始时氢离子浓度较大,发生的反应为![]() ,A错误;
,A错误;
B. 草酸为弱酸,在离子方程式中不能拆,B错误;
C. 往少量澄清石灰水中加入Ca(HCO3)2溶液,方程式为Ca2++OH-+HCO3-=CaCO3↓+H2O,C正确;
D. 铁离子具有较强的氧化性,碘离子具有较强的还原性,二者会发生氧化还原反应而不共存,离子方程式不正确,D错误;
故答案选C。

 阅读快车系列答案
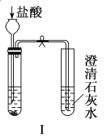
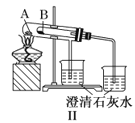
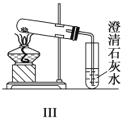
阅读快车系列答案【题目】某探究性学习小组设计如图所示装置分别进行如下探究实验,请回答下列问题:
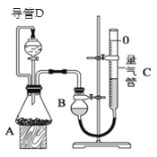
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | Na OH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是__________________________;
(2)实验Ⅱ中量气管中的液体最好是_______(填字母编号,下同)
A.NaOH溶液B.氨水C.煤油D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是________;
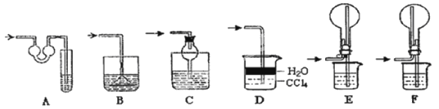
(3)①写出实验Ⅲ中涉及的离子反应方程式_________________________;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是________________,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为_______________。