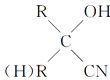
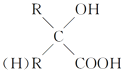
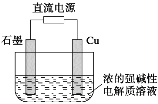
题目内容
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
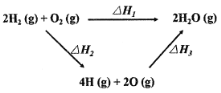
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
【答案】A
【解析】
A.体系能量降低和混乱度增大都有促使反应自发进行的倾向,该反应属于混乱度减小的反应,能自发说明该反应为放热反应,即H<0,故A正确;
B.氢氧燃料电池,氢气作负极,失电子发生氧化反应,中性条件的电极反应式为:2H2 - 4e- =4H+,故B错误;
C.常温常压下,Vm≠22.L/mol,无法根据气体体积进行微粒数目的计算,故C错误;
D.反应中,应该如下估算:H=反应中断裂旧化学键的键能之和-反应中形成新共价键的键能之和,故D错误;
故选A。

练习册系列答案
 目标测试系列答案
目标测试系列答案
相关题目