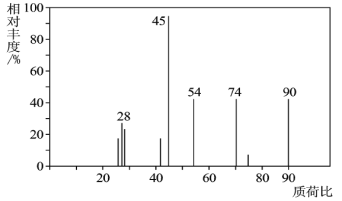
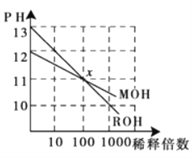
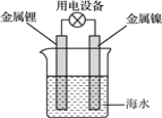
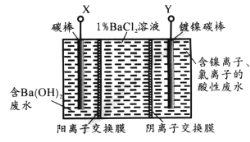
题目内容
【题目】CO2的减排已经引起国际社会的广泛关注,近日我国科学家实现了CO2高选择性、高稳定性加氢合成甲醇(CH3OH)。回答下列问题:
(1)CH3OH的摩尔质量是__gmol-1。
(2)2molH2O中所含原子的物质的量为__mol。
(3)__g的氢气中所含H原子的数目与1molCH3OH相同。
(4)含0.1NA个O的CO2中有__个电子,标况下该CO2的体积为__L。
【答案】32 6 4 1.1NA 1.12L
【解析】
(1)摩尔质量的数值等于相对分子质量,单位为gmol-1。
(2)计算分子中所含原子数,应利用化学式建立关系式。
(3)求含相同某原子的两分子的质量或物质的量关系,可利用相等的原子建立两分子的数量关系。
(4)利用分子中的一个量求另一个量,可利用化学式建立关系式,再利用公式进行转换。
(1)M(CH3OH)=(12×1+1×4+16×1 )gmol-1=32gmol-1。答案为:32;
(2)已知每个水分子中含有两个氢原子和一个氧原子,则n(原子数)=3×2 mol=6mol。答案为:6;
(3)1mol CH3OH中含有n(H)=4×1mol=4 mol,则氢气中氢原子物质的量也为4 mol,那么n(H2)=2 mol,m(H2)=2mol×2 gmol-1=4g。答案为:4;
(4)n(O)=![]() =0.1mol,那么n(CO2)=0.05mol,又因为每个CO2中含有电子数为6+8×2=22个,则含0.1NA个O的CO2中有电子数= n(CO2)×NA×22=1.1NA,V(CO2)= n(CO2)×Vm=0.05mol×22.4 Lmol-1=1.12 L。答案为:1.1NA;1.12L。
=0.1mol,那么n(CO2)=0.05mol,又因为每个CO2中含有电子数为6+8×2=22个,则含0.1NA个O的CO2中有电子数= n(CO2)×NA×22=1.1NA,V(CO2)= n(CO2)×Vm=0.05mol×22.4 Lmol-1=1.12 L。答案为:1.1NA;1.12L。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) = CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) = 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) = 2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(______)4mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(______)3mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
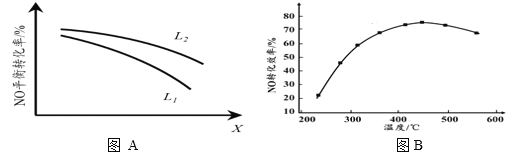
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______________________________。
(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =___________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率是不是对应温度下的平衡转化率及判断理由是________________________;