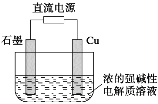
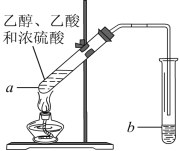
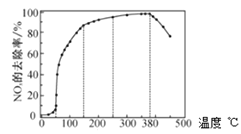
题目内容
【题目】为纪念迪米特里·门捷列夫发明的元素周期表诞生150周年,联合国大会宣布2019年是“国际化学元素周期表年”.元素周期表是科学界最重要的成就之一,表是元素周期表的一部分,其中每个数字序号代表一种短周期元素.

请按要求回答下列问题:
(1)将①、②和③三种元素相比较,非金属性最强的是(填元素符号)______;用原子结构解释原因,理由是:_________
(2)元素②与⑥的氢化物的稳定性顺序为________(填化学式);
(3)元素②与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,Y与①的最高价氧化物反应的化学方程式为__________
(4)元素④和元素⑤的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是___
【答案】F 在同周期中,随着核电荷数增大,原子半径减小,得电子的能力增强 H2O>H2S ![]()
![]()
【解析】
由元素在元素周期表中的位置可知,①为C元素,②为O元素,③为F元素,④为Na元素,⑤为Al元素,⑥为S元素,据此结合元素及其化合物的性质进行分析解答。
(1)同周期元素从左至右,随着核电荷数增大,原子半径减小,得电子的能力增强,故非金属性依次增强,则非金属性:F>O>C,故答案为:F;随着核电荷数增大,原子半径减小,得电子的能力增强;
(2)O元素和S元素的氢化物分别为H2O和H2S,非金属性越强,氢化物越稳定,非金属性O>S,所以稳定性H2O>H2S,故答案为:H2O>H2S;
(3)O元素和Na元素形成原子个数比为1:1的化合物Y,Y在常温下为固体,焰色反应为黄色,则Y为Na2O2,C的最高价氧化物为CO2,两者反应的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)Na元素和Al元素的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,Al(OH)3具有两性,与强碱NaOH反应生成NaAlO2,反应的离子方程式为![]() ,故答案为:
,故答案为:![]() 。
。