题目内容
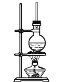
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。

实验步骤:
(1)在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
(2)当丙装置中FeC12溶液变黄时,停止加热。
(3)打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
(4)在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后停止。
(5)更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)乙中发生反应的化学方程式为_________。
(2)实验中,证明氧化性Fe3+>SO2的离子方程式为_________。
(3)将甲装置与丙装置连接的目的是_______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如图:

上述实验结果一定能够证明氧化性:Cl2>Fe3+>SO2的是______(用“I”、“II”、“III”代号回答)。
(5)若要用以上甲和丙装置证明氧化性为:Cl2> Fe3+> I2的结论,则步骤为:
①往丙的漏斗中加入两种试剂____、___和一种溶剂_____。
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化。
③如果观察到丙中溶液________则结论正确。
④停止通入Cl2
【答案】Na2SO3+H2SO4 (70%)=Na2SO4+SO2↑+H2O 2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+ 为了证明Cl2的氧化性强于Fe3+ I、III FeI2 KSCN CCl4 下层(CCl4层)先由无色变为紫红色,后看到上层溶液由浅绿色变为红色
+4H+ 为了证明Cl2的氧化性强于Fe3+ I、III FeI2 KSCN CCl4 下层(CCl4层)先由无色变为紫红色,后看到上层溶液由浅绿色变为红色
【解析】
在甲装置中MnO2与浓盐酸混合加热制取Cl2,将制取得到的Cl2通入丙装置中,发生反应2FeCl2+Cl2=2FeCl3,证明物质的氧化性:Cl2>Fe3+,溶液由浅绿色变为黄色,打开活塞c,使约2 mL的溶液滴入试管中,向其中滴加KSCN溶液,若溶液变为红色,证明反应产生了Fe3+;打开乙装置的b活塞,使硫酸进入烧瓶,发生反应产生SO2气体,将SO2气体通入丙装置的分液漏斗中,发生反应:2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+,通过检验SO
+4H+,通过检验SO![]() 证明物质的氧化性Fe3+>SO2。
证明物质的氧化性Fe3+>SO2。
(1)在装置乙中使硫酸进入烧瓶,与发生Na2SO3反应产生SO2气体,反应的化学方程式为Na2SO3+H2SO4 (70%)=Na2SO4+SO2↑+H2O;
(2)实验中,向FeCl3溶液中通入SO2气体,发生反应:2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+,溶液由黄色逐渐变为浅绿色,就证明氧化性Fe3+>SO2;
+4H+,溶液由黄色逐渐变为浅绿色,就证明氧化性Fe3+>SO2;
(3) Cl2通入丙装置中,发生反应2FeCl2+Cl2=2FeCl3,溶液由浅绿色变为黄色,证明物质的氧化性:Cl2>Fe3+,所以将甲装置与丙装置连接的目的是:为了证明Cl2的氧化性强于Fe3+;
(4)若物质的氧化性:Cl2>Fe3+>SO2,根据物质的氧化性:氧化剂>氧化产物,可知会发生反应:2Fe2++Cl2=2Cl-+2Fe3+;2Fe3++SO2+2H2O=2Fe2++SO![]() +4H+;所以只要步骤3中证明含有Fe3+,就证明氧化性Cl2>Fe3+;若步骤3中同时还存在Fe2+,说明在溶液中不存在Cl2,但是在步骤5能检验出含有SO
+4H+;所以只要步骤3中证明含有Fe3+,就证明氧化性Cl2>Fe3+;若步骤3中同时还存在Fe2+,说明在溶液中不存在Cl2,但是在步骤5能检验出含有SO![]() ,说明只能是Fe3+氧化SO2所致。因此可以证明物质的氧化性:Cl2>Fe3+>SO2,Ⅰ正确;
,说明只能是Fe3+氧化SO2所致。因此可以证明物质的氧化性:Cl2>Fe3+>SO2,Ⅰ正确;
若步骤3溶液中有Fe3+而无Fe2+,则可能是Cl2与Fe2+恰好反应,也可能是Cl2过量。因此步骤5的溶液中含有的SO![]() 也可能是Cl2氧化所致,因此不能证明该结论的正确性,Ⅱ错误;
也可能是Cl2氧化所致,因此不能证明该结论的正确性,Ⅱ错误;
若步骤3溶液中有Fe3+而无Fe2+,则可能是Cl2与Fe2+恰好反应,也可能是Cl2过量,而步骤5的溶液中含有的Fe2+,则发生反应2Fe3++ SO2+2H2O=2Fe2++SO![]() +4H+;证明氧化性Fe3+>SO2,Ⅲ正确;
+4H+;证明氧化性Fe3+>SO2,Ⅲ正确;
故合理选项是I、III;
(5)将甲装置产生的Cl2通入到丙装置中的FeI2溶液中,氯气先氧化I-产生I2单质,然后氧化Fe2+生成Fe3+,用CCl4萃取碘单质,用
①根据以上分析可知,往丙的漏斗中加入两种试剂FeI2、KSCN和一种溶剂CCl4;
②将甲装置中产生的Cl2慢慢通入丙中,观察丙的漏斗中溶液颜色变化;
③如果观察到下层(CCl4层)先由无色变为紫红色,后看到上层溶液由浅绿色变为红色,就证明结论:Cl2>Fe3+> I2。