题目内容
1.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应速率大小:X>Y |
分析 相同浓度相同体积的一元强酸和一元弱酸,氢离子浓度不同,与金属镁反应,开始时反应速率不同,强酸反应速率快,完全反应后,消耗Mg的量相同,产生氢气的量相同,据此分析.
解答 解:A、反应起始时速率X>Y,给A错误;
B、反应消耗Mg的量X=Y,给B错误;
C、产生氢气的量X=Y,给C错误;
D、相同浓度相同体积的一元强酸和一元弱酸,氢离子浓度不同,强酸溶液中氢离子浓度大,强酸反应速率快,给D正确;
故选D.
点评 本题考查了强弱电解质的区别,注意弱电解质不完全电离,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.一定条件下,向容积为2L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)?2C(g),测得相关数据如下,分析可知下列说法不正确的是( )
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol•L-1 | 1 | 2 | 1 |
| c(A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 实验Ⅲ的化学平衡常数K<1 | |
| B. | 实验放出的热量关系为b=2a | |
| C. | 实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应达到平衡 |
12.下列各组指定的元素,不能形成AB2型化合物是( )
| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
9.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃).下列说法正确的是( )
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第3周期第ⅣA族 | |
| C. | 1 mol甲与足量的乙完全反应共转移1 mol电子 | |
| D. | 化合物甲中只有离子键 |
16.在一定体积的密闭容器中通入amolNO和bmolO2,反应后容器内氮原子个数与氧原子个数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+b}$ |
13.充分燃烧某液态芳香烃X,并收集产生的全部水,恢复到室温时,得到水的质量跟原芳香烃X的质量相等.则X的分子式为( )
| A. | C10H16 | B. | C11H14 | C. | C12H18 | D. | C13H20 |
10.化学反应条件(浓度、温度、加入实际量或顺序等)的变化会影响化学反应结果.下列对产生不同化学反应结果的影响因素分析错误的是( )
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | 澄清石灰水 CO2 | 浑浊或者澄清 | CO2通入量 |
| D | Na2CO3溶液 盐酸 | 立即产生气体或最后产生气体 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
11.各取1 mol下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③顺序排列正确的是( )
①漆酚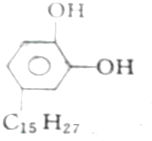
②丁香油酚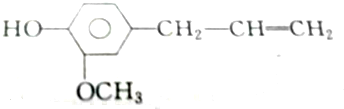
③白藜芦醇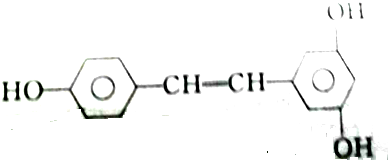
①漆酚

②丁香油酚

③白藜芦醇

| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛. ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.