题目内容
11.一定条件下,向容积为2L的密闭容器中充入一定量A和足量B,发生反应如下:2A(g)+B(s)?2C(g),测得相关数据如下,分析可知下列说法不正确的是( )| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | |
| 反应温度/℃ | 800 | 800 | 850 |
| c(A)起始/mol•L-1 | 1 | 2 | 1 |
| c(A)平衡/mol•L-1 | 0.5 | 1 | 0.85 |
| 放出的热量/kJ | a | b | c |
| A. | 实验Ⅲ的化学平衡常数K<1 | |
| B. | 实验放出的热量关系为b=2a | |
| C. | 实验Ⅲ在30 min达到平衡,30 min内A的速率:v(A)=0.002 5 mol•L-1•min-1 | |
| D. | 当容器内气体密度不随时间而变化时上述反应达到平衡 |
分析 A、根据实验Ⅲ中的数据计算出各组分浓度和化学平衡常数;
B、根据反应两边气体的体积相等,压强不影响化学平衡,实验Ⅰ和实验Ⅱ为等效平衡进行分析;
C、根据实验Ⅲ中的数据计算出A的反应速率;
D、根据B是固体,反应两边质量不相等,容器的容积固定进行判断.
解答 解:A、由于B为固体,该反应的平衡常数为:K=$\frac{c{\;}^{2}(C)}{c{\;}^{2}(A)}$.实验Ⅲ中,由于反应2A(g)+B(s)?2C(g)中,两边气体的体积相等,压强不影响平衡平衡,c(A)平衡=0.85mol/L,反应消耗了A的浓度为1mol/L-0.85mol/L=0.15mol/L,生成的C的浓度为0.15mol/L,K=$\frac{c{\;}^{2}(C)}{c{\;}^{2}(A)}$=$\frac{0.15{\;}^{2}}{0.85{\;}^{2}}$<1,故A正确;
B、反应两边气体的体积相等,压强不影响化学平衡,实验Ⅰ和实验Ⅱ为等效平衡,反应消耗的A的物质的量,实验Ⅱ是实验Ⅰ的2倍,放出的热量b=2a,故B正确;
C、根据A项的计算,A的浓度变化是0.15mol/L,A的平均反应速率为:$\frac{0.15mol/L}{30min}$=0.005mol•L-1•min-1,故C错误;
D、由于反应方程式中B是固体,反应两边气体的质量不相等,而容器的容积固定,根据ρ=$\frac{m}{V}$,V是定值,密度不变,说明混合气体的质量不变,正逆反应速率相等,达到了平衡状态,故D正确;
故选:C.
点评 本题考查了化学平衡的计算,涉及了化学平衡常数的计算、化学平衡状态的判断、化学反应速率的计算等知识,计算量稍大,解题时需要合理分析,联系所学知识完成,本题难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
1.下列关于阿伏加德罗常数(NA)的说法错误的是( )
| A. | 32g氧气所含的原子数目为NA | |
| B. | 0.5 mol H2O含有的原子数目为1.5NA | |
| C. | 1 mol H2O含有的H2O分子数目为1 NA | |
| D. | 0.5 NA 个氯气分子的物质的量为0.5 mol |
2.我国的“神舟五号”载入飞船已发射成功,我国“嫦娥工程”探月计划也已正式启动,探月计划的一个重要目标是开发月球新能源--${\;}_{2}^{3}$He.据科学家预测,月球上的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨核聚变所释放的能量相当于人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法中不正确的是 ( )
| A. | ${\;}_{2}^{4}$He原子核内含有2个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有1个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层有两个电子,所以化学性质活泼 |
6.由于催化作用使反应速率加快的是( )
| A. | 乙酸乙酯的水解,加入少量稀硫酸 | B. | 苯和溴反应时,加入少量铁粉 | ||
| C. | 实验室制取甲烷时,要加入生石灰 | D. | 锌与盐酸反应,加入少量浓硫酸 |
16.常温时,下列试剂能用铁制容器盛放的是( )
| A. | 胆矾溶液 | B. | 浓食盐 | C. | 浓硝酸 | D. | 浓AlCl3溶液 |
3.铜有两种常见的氧化物:CuO和Cu2O.某学习小组取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;则下列分析正确的是( )
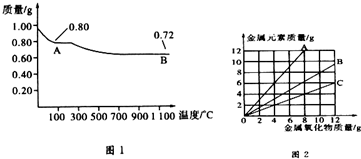

| A. | 图1中产物A、B的化学式分别为Cu2O和CuO | |
| B. | 图1整个过程中共生成0.26g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C | |
| D. | 图1中,A到B过程中有0.01 mol电子发生了转移 |
20.下列实验中,合理的是( )
| A. | 用25mL碱式滴定管量取18.40mL NaOH溶液 | |
| B. | 用100mL 量筒量取5.20mL 盐酸 | |
| C. | 用托盘天平称取25.20g NaCl固体 | |
| D. | 用100mL 容量瓶配制125mL 0.1mol•L-1盐酸 |
1.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应速率大小:X>Y |