题目内容
6. 镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍及其化合物在合金材料以及催化剂等方面应用广泛.(1)基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是C(填元素符号).
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式N2、CN-.
(3)很多不饱和有机物在Ni催化下与H2发生加成反应,如①CH2=CH2②HC≡CH、③
 ④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.
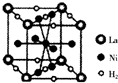
④HCHO,其中碳原子采取sp2杂化有①③④,HCHO分子内σ键与π键个数之比为3:1.(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,如图是一种镍镧合金储氢后的晶胞结构示意图,该合金储氢后,含1mol La的合金可吸附H2的数目为3NA.
分析 (1)镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式;Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(2)等电子体中原子数相同、价电子数相同,据此解答即可;
(3)根据碳原子含有的σ键和孤电子对判断碳原子采取的杂化方式; 根据单键为σ键,双键中1个σ键和1个π键回答;
(4)由晶胞可知,晶胞中La位于定点,平均含有8×$\frac{1}{8}$=1,Ni位于面心和体心,共含有8×$\frac{1}{2}$+1=5,H2位于边和面心,共有8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,以此解答.
解答 解:①镍属于28号元素,根据构造原理可以写出该原子的核外电子排布式,Ni的核外电子排布式是1s22s22p63s23p63d84s2,第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,故答案为:1s22s22p63s23p63d84s2;C;
(2)CO含有2个原子14个电子,所以CO互为等电子体的一种分子和一种离子的化学式为:N2、CN-(或O22+、C22-、NO+),故答案为:N2;CN-;
(3)①CH2=CH2中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
②HC≡CH中每个碳原子含有2个σ键,不含孤电子对,所以采取sp杂化,故错误;
③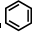 中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
中每个碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
④HCHO中碳原子含有3个σ键,不含孤电子对,所以采取sp2杂化,故正确;
HCHO中碳原子含有3个σ键,1个π键,HCHO分子内σ键与π键个数之比为3:1,
故答案为:①③④;3:1;
(4)由晶胞可知,晶胞中La位于定点,平均含有8×$\frac{1}{8}$=1,Ni位于面心和体心,共含有8×$\frac{1}{2}$+1=5,H2位于边和面心,共有8×$\frac{1}{4}$+2×$\frac{1}{2}$=3,则含1mol La的合金可吸附H2的物质的量为3mol,故答案为:3NA.
点评 本题考查晶体的结构与物质的性质的相互关系及应用,做题时注意电子排布式的书写方法,晶体熔点比较方法,分子空间构型的判断方法,注意学习中有关做题方法的积累.

| A. | 胆矾溶液 | B. | 浓食盐 | C. | 浓硝酸 | D. | 浓AlCl3溶液 |
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应速率大小:X>Y |
| A. | 烷烃与烯烃不可能是同分异构体 | |
| B. | 同分异构体只能存在于有机化合物之间 | |
| C. | 乙酸和甲酸甲酯不互为同分异构体 | |
| D. | 乙醇、丙三醇互为同系物,同系物之间不可能互为同分异构体 |
 焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
焦亚硫酸钠(Na2S2O5)是一种常用的抗氧化剂.某研究小组对焦亚硫酸钠进行如下研究:
 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题: