题目内容
12.下列各组指定的元素,不能形成AB2型化合物是( )| A. | 2s22p2和2s22p4 | B. | 3s23p4和2s22p4 | C. | 3s2和2s22p5 | D. | 3s1和3s23p4 |
分析 AB2型化合物中A的化合价为+2或者+4价,B的化合价为-1或-2价,根据价电子排布判断化合价是否符合.
解答 解:A.价层电子排布为2S22P2的元素为C,价层电子排布为2S22P4的元素为O,二者可形成CO2,故A不选;
B.价层电子排布为3S23P4的元素为S,价层电子排布为2S22P4的元素为O,二者可形成SO2,故B不选;
C.价层电子排布为3S2的元素为Mg,价层电子排布为2S22P5的元素为F,二者可形成MgF2,故C不选;
D.价层电子排布为3S1的元素为Na,价层电子排布为3S23P4的元素为S,二者可形成Na2S,与题目不符,故D选.
故选D.
点评 本题考查原子核外电子排布,题目难度不大,本题注意把握核外电子的排布特点,把握常见元素的化合价.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.我国的“神舟五号”载入飞船已发射成功,我国“嫦娥工程”探月计划也已正式启动,探月计划的一个重要目标是开发月球新能源--${\;}_{2}^{3}$He.据科学家预测,月球上的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨核聚变所释放的能量相当于人类一年消耗的能量.在地球上,氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法中不正确的是 ( )
| A. | ${\;}_{2}^{4}$He原子核内含有2个质子 | |
| B. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| C. | ${\;}_{2}^{3}$He原子核内含有1个中子 | |
| D. | ${\;}_{2}^{4}$He的最外层有两个电子,所以化学性质活泼 |
3.铜有两种常见的氧化物:CuO和Cu2O.某学习小组取0.98g Cu(OH)2固体加热,有铜的氧化物生成,其质量随温度变化如图1所示;另外,某同学绘制了三条表示金属氧化物与其所含金属元素的质量的关系曲线,如图2所示;则下列分析正确的是( )
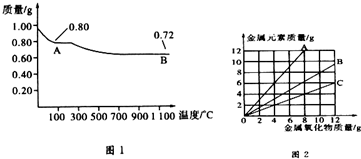

| A. | 图1中产物A、B的化学式分别为Cu2O和CuO | |
| B. | 图1整个过程中共生成0.26g水 | |
| C. | 图2三条曲线中,表示CuO和其中所含Cu元素质量关系的曲线是C | |
| D. | 图1中,A到B过程中有0.01 mol电子发生了转移 |
20.下列实验中,合理的是( )
| A. | 用25mL碱式滴定管量取18.40mL NaOH溶液 | |
| B. | 用100mL 量筒量取5.20mL 盐酸 | |
| C. | 用托盘天平称取25.20g NaCl固体 | |
| D. | 用100mL 容量瓶配制125mL 0.1mol•L-1盐酸 |
7.已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4.一般而言,该式中m大的是强酸,m小的是弱酸.下列各含氧酸中酸性最强的是( )
| A. | H2SeO3 | B. | HMnO4 | C. | H3BO3 | D. | H3PO4 |
17.按所示格式填写下表有序号的表格:
| 原子序数 | 电子排布式 | 价层电子排布 | 周期 | 族 |
| 17 | ①1s2 2s22p6 3s23p5 | ②3s23p5 | ③3 | ④ⅤⅡA |
| ⑤10 | 1s22s22p6 | ⑥2s22p6 | ⑦2 | ⑧0 |
| ⑨24 | ⑩1s2 2s22p6 3s23p63d5 4s1 | 3d54s1 | (11) | ⅥB |
4.下列说法正确的是( )
| A. | 自发反应的熵一定增大,非自发反应的熵一定减小 | |
| B. | 凡是放热反应都是自发的,因为吸热反应都是非自发的 | |
| C. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| D. | 常温下,反应C(s)+CO2(g)?2CO(g)不能自发进行,则该反应的△H>0 |
1.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应速率大小:X>Y |
2.C、N、O、Na、S、Cl是常见的六种短周期元素
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
(3)(CN)2分子中所有原子均达到8电子稳定结构,该分子中α键与π键之比为3:4,氨气可作低温溶剂,它易液化的原因是NH3分子间可形成氢键,沸点显著升高,易液化.
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目: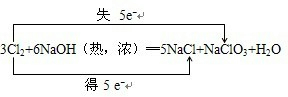 .
.
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目:
 .
.