题目内容
11.各取1 mol下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③顺序排列正确的是( )①漆酚
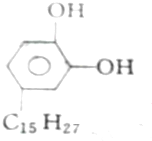
②丁香油酚
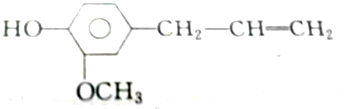
③白藜芦醇
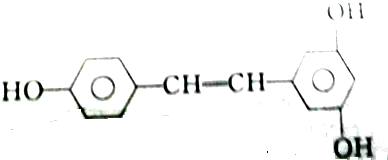
| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
分析 碳碳不饱和键键能和溴发生加成反应,苯环上酚羟基邻对位氢原子能被溴取代,据此分析解答.
解答 解:碳碳不饱和键键能和溴发生加成反应,苯环上酚羟基邻对位氢原子能被溴取代,
①中含有酚羟基,-C15H27中含有两个碳碳双键或一个碳碳三键,1mol该物质能和5mol溴反应;
②中含有酚羟基和碳碳双键,能和2mol溴反应;
③中含有酚羟基、碳碳双键,能和6mol溴反应,
通过以上分析知,各取1 mol下列物质与溴水充分反应,消耗Br2的物质的量按①、②、③顺序分别是5mol、2mol、6mol,故选B.
点评 本题考查有机物结构和性质,为高考高频点,明确酚中哪些氢原子能被溴取代是解本题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.相同浓度的一元强酸X溶液和一元弱酸Y溶液各10mL分别与足量金属镁反应.下列叙述正确的是( )
| A. | 反应起始时速率:X=Y | B. | 反应消耗镁的量:X<Y | ||
| C. | 产生H2量:X>Y | D. | 反应速率大小:X>Y |
2.C、N、O、Na、S、Cl是常见的六种短周期元素
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
(3)(CN)2分子中所有原子均达到8电子稳定结构,该分子中α键与π键之比为3:4,氨气可作低温溶剂,它易液化的原因是NH3分子间可形成氢键,沸点显著升高,易液化.
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目: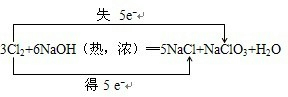 .
.
(1)S位于元素周期表第三周期第ⅥA族,Na的基态原子核外电子排布式为1s22s22p63s1.
(2)用“>”或“<”填空
| 未成对电子数 | 电负性 | 气态氢化物稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
(4)加热条件下,Cl2通过浓NaOH溶液中生成两种钠盐(物质的量之比为1:5),写出反应的化学方程式并标出电子转移的方向的数目:
 .
.
19.关于元素周期表和元素周期律的应用有如下叙述:其中正确的是( )
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
①元素周期表是同学们学习化学知识的一种重要工具;
②利用元素周期表可以预测新元素的原子结构和性质;
③利用元素周期表和元素周期律可以预言新元素;
④利用元素周期表可以指导寻找某些特殊的材料.
| A. | ①②③④ | B. | ②③④ | C. | ③④ | D. | ②③ |
3.欲从苯酚的乙醇溶液中回收苯酚,有下列操作,其中合理的步骤是( )
①蒸馏 ②过滤 ③分液 ④加入足量的钠⑤通入过量的C02⑥加入足量的NaOH溶液⑦加人足 FeCl3溶液⑧加入乙醇和浓硫酸的混合液⑨加人足 量的浓溴水⑩加人适量的盐酸.
①蒸馏 ②过滤 ③分液 ④加入足量的钠⑤通入过量的C02⑥加入足量的NaOH溶液⑦加人足 FeCl3溶液⑧加入乙醇和浓硫酸的混合液⑨加人足 量的浓溴水⑩加人适量的盐酸.
| A. | ④⑤⑩ | B. | ⑥①⑤③ | C. | ⑨②⑧① | D. | ⑦①③⑩ |
20.已知二氯苯的同分异构体有三种,从而可以推知四氯苯的同分异构体数目是( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
18.按要求写出以下方程式:
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为CO(g)+2H2(g)?CH3OH (g)△H=-116 kJ•mol-1
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
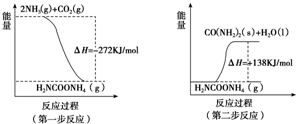
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式: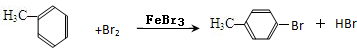 或
或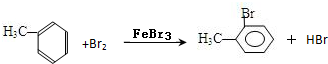
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
(1)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇.
已知某些化学键的键能数据如下表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能/kJ•mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
(2)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:

则NH3(g)与CO2(g)反应生成尿素的热化学方程式为2NH3(g)+CO2(g)?H2O(l)+H2NCONH2(s)△H=-134kJ•mol-1.
(3)2-丙醇消去生成烯烃的化学方程式:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O
(4)甲苯与Br2,FeBr3混合加热生成一溴代物的化学方程式:
 或
或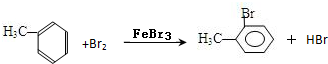
(5)Na2S2O3溶液中加入稀硫酸的离子方程式:S2O32-+2H+=SO2↑+S↓+H2O.
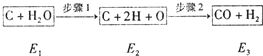 碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题:
碳和水蒸汽的反应是吸热反应,如图所示是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量(E),试回答下列问题: