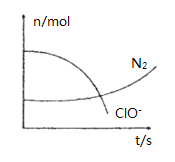
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用 元素符号或化学式 填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是_________,其离子的原子结构示意图为_____________
(2)①~⑩元素中,最不活泼的元素是____________,元素的最高价氧化物对应的水化物中酸性最强的酸是___________, 碱性最强的碱是_____________,呈两性的氢氧化物是
(3)按要求填写: ①的氢化物的电子式__________________;用电子式表示 ③和⑦形成化合物的形成过程__________________________________________;
(4)② ⑦和⑩的单质的氧化性由强到弱顺序是_________________________________,可用说明⑦和⑩的单质氧化性强弱的反应事实是(用化学反应方程式表示):__________________________________
【答案】Na  Ar HClO4 KOH Al(OH)3
Ar HClO4 KOH Al(OH)3 ![]()
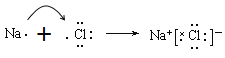 F2>Cl2>Br2 2NaBr+Cl2=2NaCl+Br2
F2>Cl2>Br2 2NaBr+Cl2=2NaCl+Br2
【解析】
根据元素周期表的结构分析,①~⑩中元素分别为氮、氟、钠、镁、铝、硅、氯、氩、钾、溴。据此回答。
(1)③~⑦元素为第三周期元素,原子半径从左到右依次减小,所以其中原子半径最大的是钠,其离子的结构示意图为 。
。
(2)①~⑩元素中,最不活泼的元素是稀有气体元素Ar,非金属性越强,最高价含氧酸的酸性越强,则元素的最高价氧化物对应的水化物中酸性最强的酸是HClO4,金属性越强,最高价水化物的碱性越强,则碱性最强的碱是KOH,呈两性的氢氧化物是Al(OH)3;
(3)①的氢化物是氨气,含有共价键的共价化合物,电子式为![]() ;③和⑦形成化合物是离子化合物氯化钠,用电子式表示③和⑦形成化合物的形成过程为
;③和⑦形成化合物是离子化合物氯化钠,用电子式表示③和⑦形成化合物的形成过程为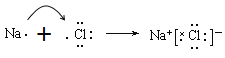 ;
;
(4)同主族从上到下非金属性逐渐减弱,则②、⑦和⑩的单质的氧化性由强到弱顺序是F2>Cl2>Br2,氯气能置换出溴可说明⑦和⑩的单质氧化性强弱,则反应的方程式为2NaBr+Cl2=2NaCl+Br2。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案