题目内容
【题目】在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(Ⅰ)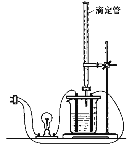 (Ⅱ)
(Ⅱ)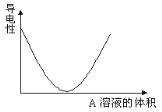
(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,可能的原因是______________。
(2)试根据离子反应的特点分析,溶液A中含有的溶质可能是(填序号)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式_______________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_________。写出NaHSO4溶液与NaHCO3溶液混合的离子方程式_________。
(4)有以下物质:①石墨; ②氯化氢气体; ③酒精; ④铝; ⑤二氧化碳; ⑥碳酸氢钠固体;⑦氢氧化钡溶液; ⑧液态醋酸; ⑨氯化银固体; ⑩氨气。
①其中能导电的是:____________________________;
②属于非电解质的是:__________________________。
【答案】溶液中的离子浓度很小,几乎不导电 ② NaHSO4=Na++H++SO42- 盐 2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O Ba2++SO42- = BaSO4↓ HCO3-+H+=CO2↑+H2O ①④⑦ ③⑤⑩
【解析】
(1)从图Ⅱ分析可知,随着A的加入溶液导电能力迅速降低,说明A必定能与Ba(OH)2发生反应,使溶液中离子浓度变得极小;(2)A不仅与Ba2+反应转化为沉淀,还要与OH—反应生成水或其它弱电解质,当反应完全后,过量A的加入,导电能力又显著上升,说明A应为强电解质;
(3)①0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,说明NaHSO4完全电离出钠离子、氢离子、硫酸根离子;
②根据酸碱盐的定义判断;
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,说明氢离子与氢氧根离子恰好完全反应,则NaHSO4与Ba(OH)2的比为2:1;在以上中性溶液中含有SO42-,继续滴加Ba(OH)2溶液生成硫酸钡沉淀。NaHSO4溶液与NaHCO3溶液混合生成硫酸钠、二氧化碳、水。
(4)根据电解质、非电解质的定义判断。
(1)从图Ⅱ分析可知,随着A的加入溶液导电能力迅速降低,说明A必定能与Ba(OH)2发生反应,使溶液中离子浓度变得极小,几乎不导电,灯泡可能熄灭;(2) ①HCl与Ba(OH)2反应生成氯化钡和水,氯化钡溶液可导电,故不选①; ②H2SO4与Ba(OH)2反应生成硫酸钡沉淀和水,硫酸钡和水均不导电,故选②; ③NaHSO4与Ba(OH)2反应生成硫酸钡沉淀、水、硫酸钠,硫酸钠溶液导电,故不选③; ④NaHCO3 与Ba(OH)2反应生成碳酸钡、水、碳酸钠,碳酸钠溶液能导电,故不选④;
(3)①0.1 mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,说明NaHSO4完全电离出钠离子、氢离子、硫酸根离子,电离方程式是NaHSO4=Na++H++SO42-;
②能电离出金属阳离子和酸根阴离子的化合物是盐,NaHSO4能电离出Na+、SO42-,属于盐;
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,说明氢离子与氢氧根离子恰好完全反应,则NaHSO4与Ba(OH)2的比为2:1,反应的离子方程式是2H++SO42-+Ba2++2OH- = BaSO4↓+2H2O;在以上中性溶液中含有SO42-,继续滴加Ba(OH)2溶液生成硫酸钡沉淀,此步反应的离子方程式是Ba2++SO42- = BaSO4↓。NaHSO4溶液与NaHCO3溶液混合生成硫酸钠、二氧化碳、水。离子方程式是HCO3-+H+=CO2↑+H2O;
(4)①石墨、②铝存在能自由移动的带负电的电子,⑦氢氧化钡溶液有能自由移动的阴、阳离子,故能导电是①、②、⑦;
非电解质是在水溶液或熔融状态下都不能能够导电的化合物,③酒精和、⑤二氧化碳、⑩氨气在水溶液中或熔融状态下都不能因自身电离而导电,属于非电解质的是③、⑤、⑩。

 阅读快车系列答案
阅读快车系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用 元素符号或化学式 填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是_________,其离子的原子结构示意图为_____________
(2)①~⑩元素中,最不活泼的元素是____________,元素的最高价氧化物对应的水化物中酸性最强的酸是___________, 碱性最强的碱是_____________,呈两性的氢氧化物是
(3)按要求填写: ①的氢化物的电子式__________________;用电子式表示 ③和⑦形成化合物的形成过程__________________________________________;
(4)② ⑦和⑩的单质的氧化性由强到弱顺序是_________________________________,可用说明⑦和⑩的单质氧化性强弱的反应事实是(用化学反应方程式表示):__________________________________
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。请根据下表中短周期元素的原子半径和主要化合价,回答表后问题。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10 m) | 0.74 | 1.60 | 0.53 | 1.10 | 0.99 | 1.11 | 0.75 | 1.43 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +2 | +5 | +3 | |
-2 | -3 | -1 | -3 |
(1)元素①在周期表中的位置为_____。
(2)元素①、⑦的氢化物的稳定性由强到弱的顺序为____(填化学式)。
(3)元素①、③形成的18电子化合物的电子式为____,元素②、⑧的最高价氧化物对应的水化物中,碱性较强的是______(填化学式)。
(4)元素②、⑤形成化合物的电子式为_____。
(5)元素⑤的最高价氧化物对应的水化物的水溶液与元素⑧的最高价氧化物对应水化物反应的离子方程式为

