题目内容
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
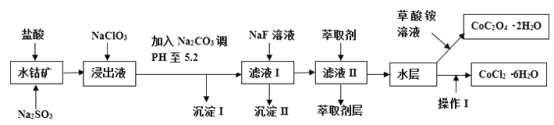
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等;②沉淀I中只含有两种沉淀;③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中Co2O3发生反应的离子反应方程式为_________________。
(2)NaClO3在浸出液中发生的离子反应方程式为______________。
(3)加入Na2CO3调PH至5.2,目的是________;萃取剂层含锰元素,则沉淀II的主要成分为_____。
(4)操作I包括:将水层加入浓盐酸调整PH为2-3,______、_____、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是_____(回答一条原因即可)。
【答案】Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O 使Fe3+和Al3+沉淀完全 CaF2和MgF2 蒸发浓缩 冷却结晶 产品中结晶水含量低;产品中混有氯化钠杂质(回答一条即可)
【解析】
在盐酸和Na2SO3作用下将水钴矿中的离子浸出,得到含有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+的浸出液,NaClO3加入浸出液中,将Fe2+氧化为Fe3+,加Na2CO3调pH至5.2,目的是使Fe3+和Al3+沉淀完全转化为氢氧化铝和氢氧化铁沉淀。过滤后得到滤液Ⅰ中含有的金属阳离子为Co2+、Mn2+、Mg2+、Ca2+等,向滤液Ⅰ中加入了NaF溶液,将Mg2+、Ca2+转化为MgF2、CaF2沉淀,加盐酸调节溶液PH值,加萃取剂将锰元素从溶液中分离,经分液操作,对分离后的水层溶液加入浓盐酸调整PH为2-3,经过蒸发浓缩、冷却结晶过滤、洗涤、减压烘干等过程,最终得到所制备的产品。
(1)浸出过程中,Co2O3与盐酸、Na2SO3发生反应,Co2O3转化为Co2+,Co元素化合价降低,则S元素化合价升高,SO32-转化为SO42-,根据得失电子守恒、电荷守恒和原子守恒配平离子方程式: Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O。
答案为:Co2O3+SO32-+4H+= 2Co2++ SO42-+2H2O;
(2)NaClO3加入浸出液中,将Fe2+氧化为Fe3+,ClO3-被还原为Cl-,反应的离子方程式为: ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O。
答案为: ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)根据工艺流程图,结合表格中提供的数据可知,加Na2CO3调pH至5.2,目的是使Fe3+和Al3+沉淀完全。滤液Ⅰ中含有的金属阳离子为Co2+、Mn2+、Mg2+、Ca2+等,萃取剂层含锰元素,结合流程图中向滤液Ⅰ中加入了NaF溶液,知沉淀Ⅱ为MgF2、CaF2。
答案为:使Fe3+和Al3+沉淀完全;CaF2和MgF2
(4)经过操作Ⅰ由溶液得到结晶水合物,故除题中已知过程外,操作Ⅰ还包括蒸发浓缩、冷却结晶。
答案为:蒸发浓缩 ;冷却结晶
(5)根据CoCl2·6H2O的组成及测定过程分析,造成粗产品中CoCl2·6H2O的质量分数大于100%的原因可能是:含有氯化钠杂质,使氯离子含量增大或结晶水合物失去部分结晶水,导致相同质量的固体中氯离子含量变大。
答案为:产品中结晶水含量低;产品中混有氯化钠杂质(回答一条即可)

 走进文言文系列答案
走进文言文系列答案【题目】某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选甲基橙作指示剂。
(1)配制250mL 0.2000 mol/L盐酸标准溶液,所需玻璃仪器有______、______量筒、烧杯、玻璃棒。
(2)盛装0.2000 mol/L盐酸标准液应该用______式滴定管。(填“酸”或“碱”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_________,直到加入一滴盐酸后,溶液由_________,即到终点。
(4)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;⑥滴定操作
正确的操作顺序为:_________。
(5)有关数据记录如下:
实验序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.60 | 20.70 |
2 | 20.00 | 6.00 | 25.90 |
3 | 20.00 | 1.40 | 23.20 |
则NaOH溶液的物质的量浓度为__________mol/L。
(6)若滴定时锥形瓶未干燥,则测定结果____________;若滴定前平视读数,滴定终点时仰视读数,则所测碱的浓度值_________。(填“无影响”、“偏高”或“偏低”)。